Coordinadora del capítulo:
Belén Pérez Dueñas. Sección de Neurología Infantil. Hospital Vall d’Hebrón – Vall d’Hebrón Research Institute (VHIR). Universidad Autónoma de Barcelona.
Autores:
- Marcos Madruga Garrido. Servicio de Neuropediatría. Hospital Virgen del Rocío, Universidad de Sevilla.
- Juan Darío Ortigoza-Escobar – Servicio de Neuropediatría. Unidad de Trastornos del Movimiento. Institut de Recerca Sant Joan de Déu – Hospital Sant Joan de Déu. Barcelona
- Marta Correa Vela. Sección de Neurología Infantil. Hospital Vall d’Hebrón – Vall d’Hebrón Research Institute (VHIR). Universidad Autónoma de Barcelona.
- Anna Duat Rodríguez. Servicio de Neuropediatría. Hospital Infantil Universitario Niño Jesús, Madrid.
- Marta Carulla Roig - Servicio de Psiquiatría. Hospital Sant Joan de Déu. Barcelona.
- Marina Fabrega Ribera –Servicio de Psiquiatría. Hospital Sant Joan de Déu. Barcelona.
- Astrid Morer - Servicio de Psiquiatría y psicología infanto-juvenil. Hospital Clinic de Barcelona. Universitat de Barcelona, Institut d'Investigacions Biomediques August Pi i Sunyer (IDIBAPS), Barcelona. Centro de Investigación Biomédica en Red Salud Mental (CIBERSAM), Barcelona
- Miguel Tomas Vila - Servicio de Neuropediatría. Hospital Universitario y Politécnico de La Fe.
- Ana Camacho Salas. Sección de Neurología Infantil. Servicio de Neurología. Hospital Universitario 12 de Octubre. Universidad Complutense de Madrid.
- Eduardo López-Laso. Unidad de Neurología Pediátrica, Unidad de Gestión Clínica de Pediatría y sus Especialidades. Hospital Universitario Reina Sofía. IMIBIC. Grupo clínico vinculado al CIBERER.
- Mª Concepción Miranda Herrero. Sección de Neurología Infantil. Servicio de Pediatría. Hospital Universitario Gregorio Marañón. Madrid
- Belén Pérez Dueñas. Sección de Neurología Infantil. Hospital Vall d’Hebrón – Vall d’Hebrón Research Institute (VHIR). Universidad Autónoma de Barcelona.
Autor de correspondencia:
Belén Pérez Dueñas
Sección de Neurología Infantil.
Hospital Vall d’Hebrón – Vall d’Hebrón Research Institute (VHIR). Universidad Autónoma de Barcelona.
Passeig Vall d’Hebrón 119-129
08035 Barcelona.
Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
ÍNDICE:
1 - Fisiopatología del síndrome de Tourette en la edad pediatrica
1.1. Base genetica
1.2. Base inmunológica
1.3. Base ambiental
1.4. Anatomía.
2 - Aspectos clínicos del Síndrome de Tourette en pediatría.
2.1. Clasificación y aspectos demográficos.
2.2. Semiología clínica.
2.3. Factores medioambientales.
3 - Diagnóstico diferencial del Síndrome de Tourette en pediatría.
3.1. Otros trastornos del movimiento
3.2. Trastorno Obsesivo-compulsivo
3.3. Epilepsia
3.4. Otras enfermedades o síntomas médicos
3.5. Trastornos del sueño
3.6. Trastornos funcionales
3.7. Tics secundarios o Tourettismo
4 - Comorbilidades psiquiátricas en pediatría.
4.1. Trastorno del Espectro Autista
4.2. Trastorno por Déficit de Atención e Hiperactividad
4.3. Trastornos del Aprendizaje
4.4. Trastorno Obsesivo Compulsivo (TOC).
4.5. Trastornos de ansiedad.
4.6. Trastornos afectivos.
4.7. Rage attacks o Explosiones de rabia.
4.8. Aspectos psicosociales.
5 - Abordaje terapéutico.
5.1. Metodología.
5.2. Análisis de la variabilidad, fiabilidad y validez de los artículos.
5.3. Protocolo de abordaje farmacológico.
5.4. Psicoeducación.
5.5. Terapias cognitivas.
5.6. Terapias físicas.
5.7. Terapias alternativas o complementarias:
5.8 Tratamiento de las comorbilidades.
5.9. Conclusiones.
1 - Fisiopatología del síndrome de Tourette en la edad pediatrica.
1.1. Base genética.
La elevada prevalencia de trastornos por tics, incluido el síndrome de Tourette, en familiares de primer grado de pacientes con dicho síndrome llevó a las sospechas iniciales del origen genético de este trastorno del neurodesarrollo, siendo el riesgo estimado de 10 a 100 veces mayor en los familiares de primer grado que en la población general1, 2 lo que indica que es uno de los trastornos neuropsiquiátricos de inicio en infancia más heredables. Estudios en gemelos determinaron una tasa de concordancia del síndrome de Tourette de un 53% en gemelos monocigóticos frente a un 8% de gemelos dicigóticos3. A pesar de la sospecha inicial de una herencia dominante, estudios en poblaciones de riesgo no han demostrado esta hipótesis, planteándose una transmisión bilineal (contribución genética en ambas ramas familiares) como posible mecanismo de herencia en este trastorno.
En la actualidad no se ha podido identificar un único gen responsable directo de las manifestaciones clínicas del síndrome de Tourette, habiéndose establecido como principal hipótesis una herencia poligénica sobre la que influirían otros factores inmunológicos o ambientales. Esta herencia poligénica estaría atribuida a numerosas variantes de riesgo comunes o poco comunes distribuidas por todo el genoma, siendo algunas de estas variantes compartidas por otros trastornos neuropsiquiátricos (TOC, TDAH, depresión o ansiedad).
Estudios de ligamiento y secuenciación dirigida relacionaron el síndrome de Tourette con múltiples genes implicados en neurotransmisión dopaminérgica (DRD2, DRD4, DAT1) y serotoninérgicas (HTR1A, HTR2C, SLC6A4) pero estos resultados no han sido ampliamente replicados. Ercan-Sencicek et al. (2010) tras el estudio de dos generaciones de una familia con síndrome de Tourette, detectó una mutación en el gen de la L-histidina decarboxilasa (HDC) muy importante en la biosíntesis de la histamina.4 La implicación de la histamina (como neurotransmisor y con función en inflamación de la microglía) en la fisiopatología del ST ha sido replicada en algunos otros estudios incluyendo modelos animales.1, 2, 5
A través de estudios de citogenética se han identificado otros genes susceptibles como IMMP2L (proteína de la membrana mitocondrial interna 2L), CNTNAP2 (proteína-like 2 asociada a la contactina) NLGN4X (neuroligina 4) ó SLITRK1 (Slit y trk-like, family member 1).6 Este último gen ha sido analizado de forma específica en otros estudios con resultados variables sin poderse establecer de forma definitiva la asociación de variante encontrada con la expresión fenotípica del síndrome de Tourette. 1
En estudios de asociación del genoma completo (GWAS) se identificaron variantes en diversos genes (entre ellos la el gen COL27A1) y que podrían considerarse variantes de riesgo.7 La replicación de estos estudios en otras poblaciones sugiere que el gen NTN4 (que codifica la netrina 4, una molécula de guía del axón que se expresa en el estriado en desarrollo) podría ser considerado como otro gen de riesgo para síndrome de Tourette.8
Amplios estudios de variaciones en número de copias (CNV) con técnicas de microarray en casos de síndrome de Tourette y controles han implicado a genes, como los que codifican para neurexina 1 (NRXN1), catenina alfa 3 (CTNN3A), contactina 6 (CNTN6) o deacetilasa arilacetamida (AADAC), con un mayor riesgo de desarrollar síndrome de Tourette2, 9
Más recientemente, un estudio de secuenciación de exomas en tríos identificó 4 genes de riesgo (WWC1, CELSR3, NIPBL y FN1) con variantes patogénicas de novo. Según estimaciones de los autores las variantes patogénicas de novo podrían estar presentes hasta en un 12% de los casos de síndrome de Tourette.2 WWC1 interviene en numerosos procesos de activación de proteínas, señalización, celularidad celular, migración y tráfico intracelular así como en aprendizaje y memoria. CELSR3 interviene en el crecimiento dendrítico. NIPBL interviene en la carga de cohesina en cromátida hermana durante la meiosis y reparación de DNA así como en la expresión de genes en el desarrollo. FN1 podría jugar papel importante en crecimiento dendrítico durante el desarrollo del cerebro.10
En relación a la comorbilidad frecuentemente asociada a síndrome de Tourette (TDAH, TOC, TEA) los estudios realizados sobre poblaciones con síndrome de Tourette junto con la frecuente presencia de estos trastornos sugieren la hipótesis de que síndrome de Tourette y estos trastornos neuropsiquiátricos comparten alteraciones genéticas comunes. Estas hipótesis parecen confirmarse con el análisis de variantes de riesgo comunes del genoma completo de 265.218 pacientes y 784.643 controles realizados por el “Brainstorm Consortium”.11 En este estudio se confirma una correlación genética positiva del síndrome Tourette con el TOC, trastorno depresivo mayor, TDAH y trastornos de ansiedad (en orden decreciente), indicando que el Síndrome de Tourette comparte con estos trastornos variantes genéticas de riesgo para padecer ambos trastornos.
1.2. Base inmunológica.
En relación al papel de los factores inmunológicos en el Síndrome de Tourette es importante destacar las primeras descripciones de PANDAS (pediatric autoinmune neuropsiquiatric disorder associated with Streptococal infection) a la que se asociaron posteriores cuadros similares no relacionados con Streptococo o PANS (pediatric acute neuropsychiatric síndrome) y que incluían tics entre sus síntomas. La inconsistencia en el hallazgo de autoanticuerpos específicos en pacientes con PANDAS y la inespecificidad de los criterios de diagnóstico ponen en debate la existencia de dicho cuadro clínico. Otros factores que relacionan el síndrome de Tourette con una disregulación inmunológica son una respuesta inmune innata alterada a infecciones bacterianas, anomalías de las células T reguladoras, elevación de citoquinas, disregulación de inmunoglobulinas, aumento de adhesión celular, presencia de bandas oligoclonales intratecales o elevación en sangre de ARNm de genes asociados a células T y la inmunidad inanata.2
1.3. Base ambiental.
En el síndrome de Tourette también se han implicados factores ambientales, los cuales actuarían a través de factores epigenéticos en la modificación de la expresión de genes de riesgo. Entre estos factores podrían incluirse la metilación del ADN, la acetilación de las histonas o la presencia de ARN no codificante.
Entre los factores ambientales destacan las complicaciones prenatales (consumo materno de café, tabaco o alcohol así como estrés), perinatales (complicaciones del parto o bajo peso al nacer) y postnatales (infecciones, alteración regulación inmune o factores estresantes).3Los factores relacionados con la gestación se han relacionado tanto con los tics como con la comorbilidad asociada, así la exposición precoz a complicaciones durante la gestación se ha relacionado con la presencia de tics crónicos, mientras que la exposición durante el parto o en primeras semanas de vida se ha relacionado con la comorbilidad TOC o TDAH.12
En resumen, del resultado de amplios estudios colaborativos (que han incluido estudios de segregación, de ligamiento, citogenética, estudios de asociación del genoma completo, de variaciones en número de copias, estudios de variaciones de novo o poco conocidas con secuenciación de exomas, o estudios de interacción genes y ambiente) se han implicado genes relacionados con la neurotransmisión, sinapsis, crecimiento dendrítico, traducción de señal, adhesión celular o inmunidad así como de la presencia de mecanismos epigenéticos que tendrían relevancia en la expresividad fenotípica del ST.
1.4. Anatomía del síndrome de Tourette.
La hipótesis más aceptada en relación a la fisiopatología de los tics en el síndrome de Tourette es la alteración en circuitos cortico-estriado-tálamo cortical. Esta hipótesis se plantea por los hallazgos anatomopatológicos postmorten, modelos animales, estudios neurofisiológicos, alteraciones de genes que se expresan en esas áreas, los efectos de los fármacos empleados para los tics y por estudios de neuroimagen estructural y funcional.
Los resultados de los estudios de neuroimagen estructural han sido variables y a veces contradictorios, limitados por discrepancias metodológicas (edad, sexo, síntomas asociados, técnicas de neuroimagen…). En cualquier caso algunos de los hallazgos encontrados sí han sido replicados y justificarían la hipótesis de alteraciones en el circuito córtico-estriado-tálamo-cortical.
Entre los hallazgos descritos a nivel cortical destacan una disminución de volumen de sustancia gris a nivel órbitofrontal, corteza prefrontal, cortex cingulado anterior, así como de la corteza sensorial y motora.13 En algunos de los estudios el adelgazamiento cortical era inversamente proporcional a la severidad de los tics, pudiendo reflejar una limitación para el control voluntario de los tics. Hay que mencionar que, si bien en varios de los estudios sobre poblaciones con tics se encontró menor volumen de estructuras de ganglios basales, (caudado y /o núcleo lenticular) en los estudios más recientes estos hallazgos no han podido ser claramente replicados en población pediátrica.14
A nivel de sustancia blanca los estudios realizados (con cierta inconsistencia de los hallazgos) se describen un menor volumen a nivel de cuerpo calloso, vías frontoestriatales y vías motoras. Otros hallazgos son alteraciones en sustancia blanca bajo la corteza del giro precentral y postcentral.13
En un estudio más reciente en población pediátrica se detectó menor volumen de sustancia blanca a nivel de corteza orbitaria y prefrontal medial, así como en zona posterior del putamen y de la ínsula (bilaterales).14
Otras hallazgos encontrados han sido menor volumen de cortex parietal o aumento de núcleos del tálamo, disminución de volumen de amígdala, hipocampo y cerebelo.13, 14
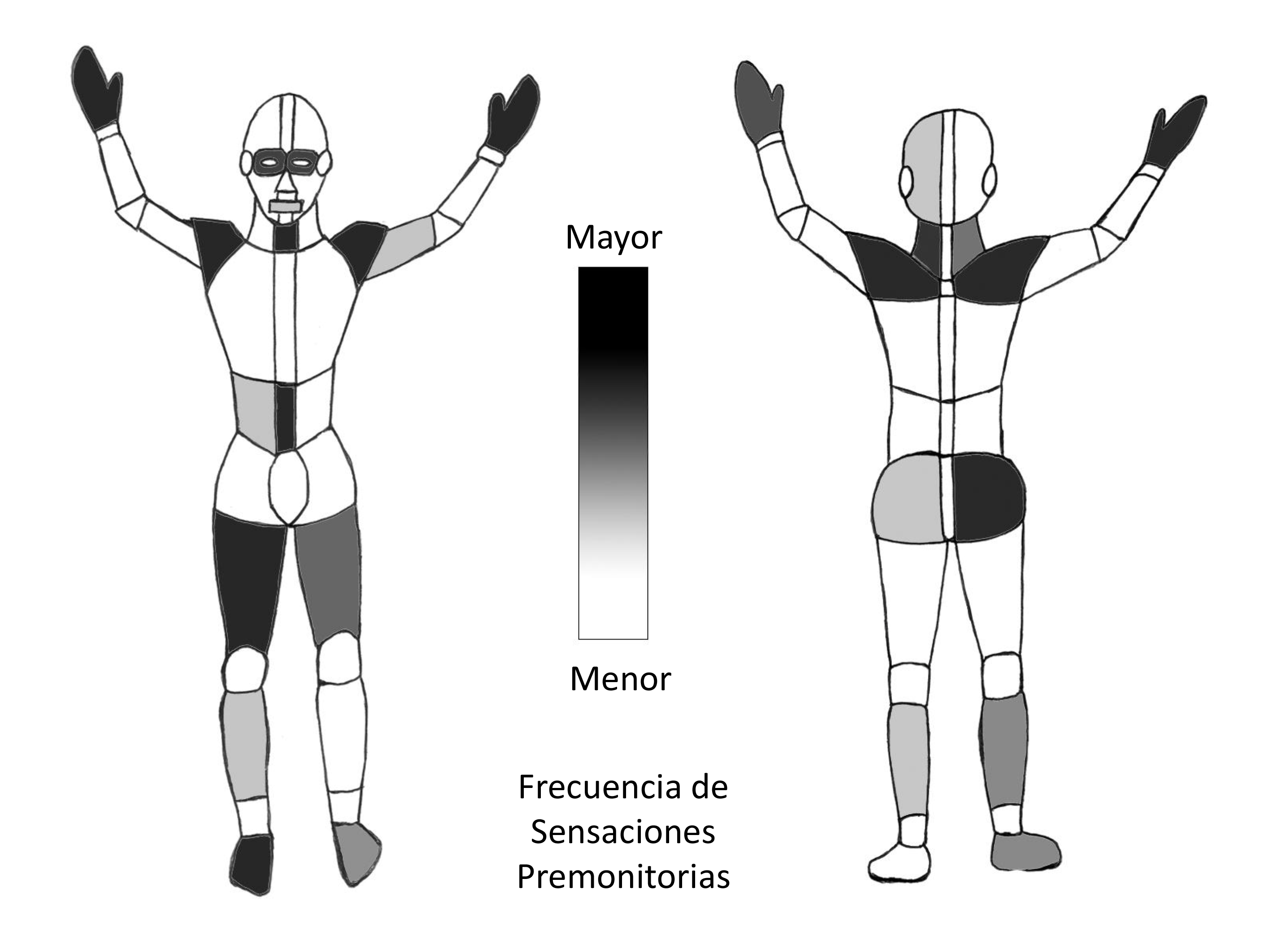
De los estudios de neuroimagen funcional (PET, Resonancia magnética funcional) se han descrito durante los tics o durante la supresión de los mismos incremento o descenso de actividad de determinadas áreas cerebrales con resultados poco concluyentes salvo la activación durante tics de áreas prefrontales y área motora suplementaria. En un estudio de neuroimagen funcional realizado con imágenes antes del inicio de los tics y durante los mismos se muestra que dos segundos antes del inicio de los tics se activan el área motora suplementaria, la corteza sensorial primaria y el opérculo parietal, un segundo antes se activan cortex cingulado anterior, ínsula, putamen, amígdala, cerebelo y cortex occipital y en el momento del inicio de los tics se activa tálamo, opérculo central, corteza motora primaria y corteza somatosensorial sugiriendo que la actividad cortical precede a la actividad en ganglios basales y localizando la sensación premonitoria que precede a los tics en área motora suplementaria y corteza sensorial.13, 15 En estudios posteriores otros autores concluyen que existe en relación a la urgencia premonitoria una activación inicial en áreas de la ínsula y cortex cingulado medial. En relación al control inhibitorio los estudios parecen demostrar una activación de áreas frontoestriatales.15
Los hallazgos de los estudios sobre conectividad estructural, con uso de imágenes de tensor de difusión, muestran un aumento de la conectividad estructural entre corteza motora, frontal y temporal con estriado y tálamo, encontrándose mayor relación de severidad de tics con conectividad de áreas motoras y de los síntomas obsesivo-compulsivos con área orbitofrontal 16
2 - Aspectos clínicos:
2.1. Clasificación y aspectos demográficos.
Los tics son el trastorno del movimiento más común en la infancia. Según el DSM-V, los tics pueden clasificarse como tics transitorios de menos de 12 meses de duración, trastorno crónico por tics motores o fónicos, y Síndrome de Tourette (ST).17 Los tics transitorios afectan hasta al 10% de los niños en edad escolar. La prevalencia del trastorno crónico por tics está entre el 2 y el 4%, y la prevalencia del ST es de 0,3 a 0,8% 18, 19
Los tics motores son el primer signo del trastorno en la mayoría de los pacientes. Según el trabajo de Caurin et al., los tics fónicos tienen un inicio significativamente más tardío (media ± DE, 7.2 ± 2.8 años) que los tics motores (media 6.2 ± 2.5 años).20 Los tics son más frecuentes entre el sexo masculino, con una proporción de hombres a mujeres de 3:1 en la mayoría de los estudios.21 Es frecuente encontrar antecedentes familiares de tics en niños con ST.20
El inicio de los tics en la edad pediátrica puede ser identificado por algunos padres coincidiendo con eventos precipitantes como el comienzo de la escuela, situaciones familiares estresantes (divorcio o nacimiento de hermanos), cambios de domicilio, etc. Estas asociaciones pueden ser anecdóticas, ya que los mecanismos que desencadenan la aparición de tics durante la infancia son complejos y posiblemente debidos a una combinación de factores genéticos y ambientales22. En nuestra población, la aparición de tics raramente se relaciona con infecciones estreptocócicas, y es extremadamente raro que las infecciones causen un aumento en la intensidad de los tics. Se ha postulado que la autoinmunidad postestreptocócica es un factor etiológico en el desarrollo de tics en algunos subgrupos de niños23, pero su papel sigue siendo controvertido en otras series24.
2.2. Semiología clínica.
Los tics suelen consistir en movimientos o sonidos abruptos, a menudo repetitivos y coordinados (estereotipados) que pueden parecerse a fragmentos de comportamiento normal y se repiten a intervalos irregulares.25 Los tics se pueden clasificar de acuerdo con los siguientes criterios: los tics motores simples involucran un solo grupo de músculos, causando un movimiento breve y brusco; los tics motores complejos se definen como movimientos coordinados y secuenciales que se asemejan a actividades motoras normales o gestos excesivamente intensos y repetitivos; Los tics fónicos simples se definen como sonidos sin significado verbal; y los tics fónicos complejos incluyen verbalizaciones y expresiones lingüísticas.
En una cohorte de 92 niños y adolescentes con tics referidos a un centro pediátrico de nivel terciario en Barcelona casi todos los niños tenían tics motores simples (97%), mientras que los tics motores complejos estaban presentes en el 73% de la cohorte. La distribución corporal de los tics motores siguió un gradiente rostro-caudal, afectando de mayor a menor frecuencia la cara, cuello, hombros y extremidades superiores, extremidades inferiores y tronco.20 La Tabla 1 muestra la semiología y clasificación de los tics en esta cohorte de pacientes.
| Tabla. Semiología y clasificación de los tics, adaptado de Caurín et al. 2014. |
|---|
Tics Motores Simples
|
|
Tics oculares:
Parpadeo, arrugar la frente, blefarospasmo, movimientos oculares.
Tics faciales:
Arrugar la nariz, hacer muecas con la boca, movimientos/sublixación mandibular, hacer pucheros con los labios, morder / chupar los labios, mover la lengua, inflar las mejillas, fruncir el ceño, dar besos, enseñar los dientes.
Tics cervicales:
Rotación, flexión, hiperextensión, sacudidas de cabeza.
Tics que afectan a las extremidades:
- Movimientos de la articulación (encogimiento de hombros o subluxación, rotación del brazo, rotación de la muñeca, movimientos de flexo-extensión de dedos de manos y pies, crujir los nudillos).
- Flexión, extensión, contracción sostenida, sacudidas musculares.
Tics axiales:
Contracciones abdominales, extensión de la columna, contracción del periné, ventosidades.
|
|
Tics Motores Complejos
|
|
Miembros superiores:
- Estirarse las pestañas, limpiar la cara, rascarse la nariz, peinars y despeinarse. Holerse las manos
- Chuparse la mano, meterse la mano dentro de la boca, morderse las uñas, morderse la camisa, golpearse los dientes con los dedos, aplaudir, tocar la ropa, hacer rituales con la mano antes de tomar un objeto, tamborilear con los dedos, tirar de un lápiz mientras se escribe
- Tocar objetos, personas, partes del cuerpo, golpear a familiares, darse golpes en el cuerpo o la cabeza.
Miembros inferiores:
- Saltar, cojear, agacharse, hacer un salto mortal.
- Avanzar y retroceder, rodear, doblar el cuerpo hacia adelante al caminar, golpear los glúteos con los talones mientras se camina, dar patadas.
|
|
Tics fónicos simples
|
|
- Olfatear. Aclarar la garganta, toser. Aspirar el aire, relizar ruidos con los labios, la lengua contra el paladar, escupir
- Reir, gritar, silbar. Imitar ruidos de animales.
- Suspirar, contener la respiración, expulsar el aire bruscamente, eructar.
|
|
Tics fónicos complejos
|
|
- Cantar. Repetir frases. Hablar solo. Alteraciones en el tono del discurso (frases finales en un tono superior, cambios de ritmo ...)
- Ecolalia, palilalia, coprolalia.
|
Los tics se consideran un trastorno de movimiento benigno26 y solo una minoría de niños con ST puede sufrir consecuencias físicas 27-29 Sin embargo, es frecuente que a lo largo de la evolución del ST y durante el período de la infancia y la adolescencia, los pacientes refieran dolor (mayoritariamente en la región cráneo-cervical que es la región con más prevalencia de tics), traumatismos menores (por ejemplo, heridas labiales, rasguños, hematomas) o tics que interfieran con el rendimiento escolar y otras actividades de la vida diaria, como dormir, comer y caminar20. La alta incidencia de complicaciones relacionadas con los tics en estos estudios puede no ser representativa de la población general de pacientes con ST, ya que los pacientes con mayor severidad clínica son aquellos que se derivan a los centros especializados.
La Escala de severidad global de tics (Yale Global Tic Severity Scale, YGTSS, por sus siglas en inglés) es una escala aceptada en todo el mundo que proporciona una evaluación del número, la frecuencia, la intensidad, la complejidad y la interferencia causada por los tics fónicos y motores.
Los pacientes con TS presentan tics más severos y complejos, obteniendo mayores puntuaciones en la YGTSS que niños con trastorno crónico por tics. Asimismo, los niños con bajo rendimiento escolar obtienen puntuaciones significativamente más altas en la YGTSS que los niños con resultados académicos normales, lo que sugiere que la gravedad del tic es un factor de riesgo para las dificultades académicas. Obviamente, las comorbilidades psiquiátricas asociadas al ST, en especial el trastorno por déficit de atención e hiperactividad (TDAH), también son un factor decisivo para el rendimiento académico. Las medidas preventivas y la reeducación académica son esenciales para evitar el bajo rendimiento escolar y otros efectos psicológicos negativos en estos niños.
2.3. Factores medioambientales:
Los tics tienen una evolución fluctuante con exacerbaciones y remisiones. Algunos estudios sugieren que los factores ambientales pueden influir en el empeoramiento de los tics (como la fatiga30, 31 y las actividades sociales) y su mejoría (como la relajación, la concentración o el estudio).28, 29 Además, varios estudios han demostrado que los pacientes con tics muestran perfiles idiosincrásicos y que los mismos factores ambientales influyen en los tics de manera diferente entre los individuos32.
En general, los niños con ST pueden experimentar una mejoría de los tics cuando se concentran en actividades artísticas o creativas, como bailar, pintar, actuar en una obra de teatro, tomar fotografías, leer o escuchar música. En este sentido, varios estudios reportan una mejoría en los tics durante actividades que requieren una mayor atención y un control del movimiento o la expresión verbal 30, 33
En el estudio de Caurin et al., un tercio de los niños reportó una reducción en los tics durante las vacaciones y cuando practicaban deportes y otras actividades al aire libre. Por el contrario, las actividades académicas que requieren concentración, pero también provocan tensión, frustración o insatisfacción, como hacer la tarea o los exámenes, especialmente en niños con TDAH, pueden empeorar los tics. Finalmente, la exposición a la televisión y los videojuegos, relacionada con el desarrollo de problemas atencionales en algunos estudios también puede agravar los tics en niños con ST, debiéndose limitar su práctica en algunos pacientes. 34, 35
El análisis de estos factores ambientales puede ser útil para que los padres, los médicos y los pacientes mismos consideren el tiempo que los niños dedican a estas actividades. De hecho, el Entrenamiento en Reversión de Hábitos y la Intervención Global de Comportamiento para Tics (HRT/CBIT, ver más adelante en el apartado de tratamiento) que integran el entrenamiento para revertir el hábito con los procedimientos diseñados para mitigar las influencias de la vida diaria que empeoran los tics, se considera un tratamiento de primera línea para las personas con ST19
3 - Diagnóstico diferencial.
La aparición de tics en un niño con un estado previamente saludable suele ser muy perturbador para las familias.36 Sin embargo, las presentaciones clásicas de los tics de inicio en la infancia no requieren más diagnóstico diferencial que el realizado por la propia anamnesis y exploración con examen neurológico y psiquiátrico.37 La presentación de tics en un niño con otros síntomas, incluido el retraso del desarrollo, otros síntomas motores, o cualquier otro hallazgo de interés en la anamnesis y exploración física, debe sugerirnos que se trate de tics secundarios y considerar investigaciones adicionales determinadas principalmente por los otros síntomas.36
Es importante mediante la anamnesis comprobar que el trastorno de movimiento que nos refieren cumple las características de los tics. Que son suprimibles (el niño puede evitar o retrasar el tic), que son predecibles (saben que ocurrirá antes de que suceda), y que se pueden reproducir a voluntad por sugestión. La predicción y control del inicio del tic permiten al niño asumir una postura corporal estable o terminar las acciones como poner un vaso de agua antes iniciar el tic para reducir el riesgo de lesión o vergüenza. Si un tic causa un trastorno funcional, el niño se cae de su silla, arroja objetos involuntariamente, tiene movimientos que perturban la escritura o la deglución debe sospecharse que los síntomas no pueden ser explicados por un trastorno por tics.36
A continuación se describen las principales entidades a considerar en el diagnóstico diferencial de los tics.
3.1. Otros trastornos del movimiento.
Los trastornos del movimiento hipercinético son los más frecuentes en la infancia. Dentro de este grupo los más frecuentes son los tics que deben diferenciarse del resto de trastornos (distonía, coreoatetosis, mioclono, temblor o estereotipia).38 Diferenciarlos no siempre es fácil dado que los tics pueden tener la apariencia de cualquier otro trastorno del movimiento, de hecho en ocasiones reciben el nombre según el trastorno al que imiten, como el caso de los tics distónicos o los tics mioclónicos.36
Corea y coreatetosis. Consiste en un movimiento involuntario, continuo, irregular, no estereotipado e impredecible. Da un aspecto de “danza”, pues los niños con corea parecen estar en constante movimiento, inquietos. Puede ocurrir en cualquier localización del cuerpo pero habitualmente las extremidades superiores y la cara están involucradas.39, 40
Algunas características de los tics permiten diferenciarlos de la coreatetosis. La falta de continuidad del movimiento, la alternancia con períodos de movimiento normal así como el hecho de no interferir con las tareas en curso. Los Tics son predecibles y repetibles con un claro inicio y final en cada movimiento como tic individual y una falta de ritmicidad en el momento del inicio del movimiento.38
Mioclonías. Consiste en breves de sacudidas musculares involuntarias, bruscas y rápidas de un músculo o grupo muscular.41 Los tics motores simples deben diferenciarse de las mioclonías. Las mioclonías no son típicamente repetitivas en la misma parte del cuerpo42 ni cumplen las características habituales en los tics de ser predecibles y repetibles38 Además es común que los tics simples estén acompañados por tics complejos y asociados con sensaciones premonitorias o supresión no presentes en las mioclonías.42
Estereotipias. Son movimientos simples repetitivos, vocalizaciones o sonidos (por ejemplo, gemidos, gritos) o comportamientos como golpear la cabeza, saludar o aletear, y están presentes durante más de 4 semanas.38 Las estereotipias se presentan de forma más frecuente en pacientes con autismo, retraso mental, síndrome de Rett, psicosis o alteraciones sensoriales como ceguera y sordera.42 Los tics motores complejos necesitan distinguirse de las estereotipias. Estas se caracterizan por presentar movimientos con mayor ritmicidad, más estereotipados y de mayor duración, y carecen de la urgencia premonitoria.38 A diferencia de los tics, las estereotipias generalmente comienzan antes de los 2 ó 3 años de edad.36, 40
Distonía. Contracciones involuntarias de un músculo de forma sostenida o intermitente que causan movimientos repetitivos y de torsión y/o posturas anormales.41 Algunos tics son lentos o bien producen posturas retorcidas asemejándose a la distonía y se denominan "tics distónicos". Contrariamente a los tics distónicos, la distonía per se tiende a ser más lenta y conduce a una alteración más sostenida en el tiempo en la postura de una extremidad, el cuello o el tronco.42 Además la distonía por lo general se desencadena e interfiere con movimiento voluntario, pero los tics generalmente son suprimidos y no interfieren con el movimiento voluntario.38
Discinesias paroxísticas. Se trata de movimientos anormales entre la distonía y la corea, los episodios son generalmente cortos, con una duración de segundos a minutos. Además de la diferencias ya descritas en la distonía y la corea ayuda a diferenciarlos de los tics, el hecho de que a menudo son precipitados por un sobresalto o se desencadenan al iniciar el movimiento. Por otro lado, una sensación inusual en las extremidades puede preceder a los síntomas.40
Temblor. Es un movimiento rítmico y oscilante alrededor de un punto fijo.41 Raramente se confunden, pero el claro inicio y fin en el tic individual así como la falta de ritmicidad en el momento en que se inicia del movimiento, ayuda a distinguir ambas entidades.38
Acatisia. Trastorno del movimiento caracterizado por una sensación de inquietud interna e incapacidad para permanecer quieto. Este es comúnmente un efecto secundario de los medicamentos antipsicóticos, antidepresivos o antieméticos. Aunque es más frecuente en adultos se puede observar también en niños. A diferencia con el síndrome de piernas inquietas la sensación no cede con el movimiento .36, 40 El tipo de movimientos no estereotipados ayuda a diferenciarlo del tic.
Los tics también se confunden con otras entidades, como epilepsia, trastornos del sueño, problemas de atención, trastorno obsesivo compulsivo y trastornos funcionales.38
3.2. Trastorno obsesivo compulsivo.
Las compulsiones son difíciles de distinguir de los tics, más aun cuando ambas entidades coexisten en pacientes con síndrome de Tourette.40 Ambos trastornos disminuyen con la concentración, aumentan con la emoción y son suprimibles38 pero por lo general difieren porque la compulsión es realizada en respuesta a una obsesión, con el objetivo de evitar futuros problemas o de acuerdo con ciertas reglas (ritualistas).42 Al ser un comportamiento dirigido a un objetivo (para reducir la angustia o bien prevenir un evento temido) 38, en general resulta menos estereotipado el movimiento en sí, aunque la acción se repita.36 Por otro lado no son tan fluctuantes como los tics en cuanto a su frecuencia e intensidad experimentando sólo pequeños cambios en el tiempo.38
3.3. Epilepsia.
Principalmente las ausencias con mioclonías parpebrales pueden ser confundidas con un trastorno por tics, presentándose en edades similares y siendo tan breve la disminución de conciencia acompañante como para pasar desapercibida.40 Las desviaciones oculares, fundamentalmente la desviación de la mirada superior podrían confundirse con ausencias epilépticas o incluso con espasmos más allá de la infancia (acompañados de una elevación de cejas).38 También algunos movimientos de las crisis focales pueden ser confundidos con tics. Pero cuando se trata de una epilepsia generalmente tienen una semiología epiléptica característica, son movimientos muy estereotipados, suelen acompañarse de disminución de conciencia y cuando ocurren de forma más intensas se siguen de un periodo postcrítico.
3.4. Trastornos del sueño.
Aunque los tics pueden presentarse durmiendo, es muy poco frecuente que esto ocurra, y no lo hacen de forma única en sueño. Cuando ocurren en sueño debe valorarse la posibilidad de que se trate de una epilepsia parcial benigna de puntas centro-temporales, parasomnias, síndrome de piernas inquietas o mioclonías del sueño.38 En el caso del síndrome de piernas inquietas una diferencia importante es la sensación desagradable a menudo aliviada por cualquier movimiento de piernas, que hace que estos movimientos no sean en general tan estereotipados y reconocibles como en el caso de los tics.36
3.5. Otras enfermedades o síntomas médicos.
En algunos casos, la sensación premonitoria al supuesto tic, representa una anormalidad real. Por ello en el caso del tic en que el niño aclara la garganta hay que valorar la presencia de una sinusitis o una alergia. Del mismo modo, un niño con un parpadeo puede tener una abrasión corneal, alergia o una disminución de la agudeza visual.36, 38 Los movimientos oculares del opsoclonus podrían confundirse con tics. Un movimiento de rascado continuo puede ser producto de alergias o infestación como escabiosis. Gesticulaciones repetidas pueden corresponder a blefaroespasmos o espasmos faciales. En tirones y movimientos cervicales se debe descartar las distonías o las discinesias por fármacos.
3.6. Trastornos funcionales psicógenos.
Finalmente, algunas formas de trastornos funcionales pueden manifestar movimientos bruscos parecidos a los tics, particularmente cuando aparecen por primera vez en la edad adulta.37 Algunas de las características propias de los tics, añaden una dificultad para diferenciar ambas entidades como la variabilidad en el tiempo, el hecho de que sean suprimibles y que se puedan reproducir por sugestión. Es importante en estos casos realizar una anamnesis minuciosa que incluya datos psicógenos/psiquiátricos. Los movimientos en el caso de trastornos funcionales psicógenos suelen ser más excesivos, complejos y llamativos, y casi siempre tienen una repercusión funcional a diferencia de los tics con los que el niño convive de forma habitual.38
3.7. Tics secundarios o Tourettismo.
Raramente los tics pueden ir asociados a otras enfermedades o ser favorecidos por fármacos o tóxicos, en estos casos nos referimos a ellos como tics secundarios o tourettismo. Una presentación atípica junto a otros síntomas en la anamnesis o en la exploración sugiere esta posibilidad.36 Hay que pensar en causas secundarias particularmente si se acompaña de otros trastornos del movimiento u otras anormalidades neurológicas42 y considerar investigaciones adicionales determinadas principalmente por los otros síntomas. Salvo las características acompañantes y la edad de inicio atípica, los tics secundarios no son diferentes en fenomenología de los tics primarios. 37
Hay que tener presente que en enfermedades en que diferentes trastornos del movimiento pueden presentarse de forma conjunta, aunque los tics no sean habituales, inicialmente pueden diagnosticarse como tic algún movimiento poco definido como en el caso de la deficiencia de Glut-1, la encefalitis por anti-NMDA o el síndrome de Lesch-Nyhan entre otros.
A continuación se describen las principales entidades que presentan tics secundarios:
Trastornos del neurodesarrollo. En muchos de estos casos los tics son un síntoma más en el contexto de un trastorno del desarrollo cerebral que se manifiesta con discapacidad cognitiva y/o trastorno de espectro autista.42 Aunque en relación al diagnóstico diferencial, hay que tener presente que también otras alteraciones del movimiento como las estereotipias son más frecuentes en estos grupos.37
Anomalías genéticas y cromosómicas. Los tics secundarios se presentan de forma más frecuente en pacientes con anomalías genéticas y cromosómicas como retraso mental ligado a X, síndrome de X-frágil, síndrome de Klinefelter, 9p o trisomía parcial 16. 37
Enfermedades neurodegenerativas. Del mismo modo, una variedad de condiciones genéticas y neurodegenerativas pueden causar tics, incluida la enfermedad de Wilson, la neurodegeneración cerebral por acumulación de hierro y la enfermedad de Huntington.42 En estas enfermedades los síntomas más comunes no son los tics pero estos pueden estar presentes. Así, la enfermedad de Wilson entre sus manifestaciones neurológicas puede presentar tics aunque son más comunes la presencia de disartria, ataxia, temblor, distonía o parkinsonismo. El trastorno del movimiento más típico asociado a la enfermedad de Huntington es la corea, seguido de otros como distonía y mioclonías, pero los tics u otros síntomas típicos del síndrome de Tourette también se han documentado. La neurodegeneración con acumulación cerebral de hierro (NBIA) es un síndrome neurodegenerativo que se manifiesta como un trastorno motor muy complejo con distonía y parkinsonismo, ataxia, espasticidad, síntomas bulbares y trastornos neuropsiquiátricos. En pacientes con formas atípicas y tardías de déficit de pantotenato-quinasa (PKAN) es frecuente observar tics motores complejos asociados a rasgos obsesivo-compulsivos y deterioro motor y cognitivo. También en el síndrome de Lesch-Nyhan las estereotipias y los trastornos de conducta se han referido como tics por algunos autores pero los tics no suelen ser frecuentes en este síndrome.36
Afectación de circuitos fronto-subcorticales. La existencia de tics secundarios también se relaciona con lesiones que involucran circuitos fronto-subcorticales producidas por traumatismo craneal, intoxicación por monóxido de carbono, encefalopatía hipóxico-isquémica y accidente cerebrovascular; tumores o inflamaciones, infecciones del sistema nervioso central como neuroborreliosis o encefalitis viral secundaria a herpes virus o VIH.42
Trastornos del sistema inmune. Se han referido tics en el síndrome de anticuerpos antifosfolípido, la corea de Sydenham42 o el trastorno neuropsiquiátrico pediátrico autoinmune asociado a infecciones estreptocócicas (PANDAS) aunque la existencia de dicha entidad continua siendo un debate en la actualidad. 37
Fármacos y tóxicos. Asimismo la inducción o exacerbación de tics en niños susceptibles ha asociado con numerosos fármacos y tóxicos. Los tics han sido referidos principalmente con antiepilépticos como lamotrigina, carbamazepina, fenitoina, fenobarbital. También antipsicóticos, antidepresivos y levodopa. Los tics tardíos se han descrito con tratamiento prolongado con antipsicóticos u otros bloqueantes de receptores de dopamina. Tóxicos como la cocaína, cafeína7, anfetamina y otros estimulantes desencadenan tics.37, 42
4 - Comorbilidades psiquiátricas.
El Síndrome de Tourette (ST) puede considerarse el prototipo de trastorno del neurodesarrollo y una entidad neurospsiquiátrica con síntomas típicos de la infancia y la adolescencia. El ST asocia las siguientes comorbilidades psiquiátricas:
4.1. Trastorno del espectro autista.
4.1.1. Definición y criterios diagnósticos
El Manual Diagnóstico y Estadístico De Los Trastornos Mentales (DSM-5) define el Trastorno del Espectro Autista (TEA) como un trastorno del neurodesarrollo que se inicia en la infancia y cuyos síntomas nucleares son los déficits de comunicación e interacción social, conductas estereotipadas e intereses restringidos y el ST como un trastorno caracterizado por múltiples tics motores y al menos uno vocal, que se presentan durante un año como mínimo y se inician antes de los 18 meses de edad.
Ambos síndromes comparten un predominio en el sexo masculino, la presencia de conductas repetitivas y estereotipadas así como el hecho de que éstas empeoren en situaciones de estrés. Además y como veremos más adelante a nivel fisiopatológico los dos trastornos presentan alteraciones en los circuitos cortico estriados.43
En términos generales la presencia de movimientos anormales entre la población con TEA es mayor que en la población general, siendo aún más frecuentes en el TEA sindrómico. Se describe entre estos pacientes una mayor frecuencia de ataxias, discinesias, episodios catatónicos-like y ST.44
4.1.2. Prevalencia
La relación entre TEA y ST es asimétrica, dependiendo de cuál de los dos trastornos se considere el primario. Así entre la población con TEA la frecuencia de tics oscila entre un 10-25%, frente a un 0,2 – 3,9% entre la población que no presenta TEA.45 Por otro lado entre la población diagnosticada de TS el porcentaje de pacientes con TEA se reporta entre un 5-15%, frente a una prevalencia en el resto de la población de 1,9%.46
Un aspecto de interés es el hecho de que entre los sujetos con ST que cumplen criterios de TEA, son más frecuentes otras comorbilidades presentes en el ST, como el trastorno obsesivo compulsivo (TOC) y el trastorno por déficit de atención e hiperactividad (TDAH). Así en el trabajo de Darrow et al., 2017 sobre una muestra de 535 pacientes con ST, el 83% de los pacientes con ST que cumplían criterios de TEA presentaban TOC frente a un 52% de los ST que no cumplían criterios de TEA. Lo mismo ocurría con el TDAH, un 78,5% de los ST que cumplía criterios de TEA presentaban TDAH, frente a un 38,3% entre aquellos que no los presentaban.
A la luz de estos datos se plantean dos hipótesis. La primera es si tanto el TEA como el ST pueden compartir un origen común genético e incluso con otros trastornos psiquiátricos. Aunque existen casos aislados de pacientes en los que se ha podido demostrar que ambos fenotipos se presentan conjuntamente como expresión de una misma alteración genética en estudios poblaciones más amplios no se ha podido demostrar este origen común.47
La otra hipótesis es que nos encontremos ante una falsa comorbilidad en la que algunos síntomas de ambos trastornos se solapan y nos distorsionen la frecuencia real de esta comorbilidad. Apoyan esta hipótesis dos hechos. En primer lugar que al llegar a la edad adulta la frecuencia de TEA en la población con TS decrece de forma dramática (22,8% en niños con TS cumplen criterios e TEA frente a un 8,7% de adultos con TS) y dado que los tics como tal, disminuyen al llegar a la edad adulta en el ST, todo ello apuntaría a que podría haber un factor de confusión entre tics y estereotipias inclinando la balanza hacia una mayor prevalencia de TEA en sujetos con TS. En segundo lugar y como ya se ha comentado, dado que la mayor frecuencia de TEA se asocie a pacientes con mayor comorbilidad, en especial al TOC (el 83% de los pacientes con TS que cumplen criterios de TEA también cumplen criterios e TOC) podría haber un factor de confusión entre síntomas de TOC y TEA mimetizando algunos síntomas de TOC el TEA y viceversa.47
Desde un punto de vista fisiopatológico ambos trastornos comparten un disbalance entre mecanismos excitatorios e inhibitorios a nivel de circuitos cotico estriados. El origen de este disbalance se piensa que es debido a una disfunción en las interneuronas que conduce a un predominio de la desinhibición en las áreas comprometidas sin que hasta el momento actual no se pueda dilucidar el mecanismo molecular exacto que conduce a esta alteración en el balance excitación/inhibición.43
4.1.3. Características clínicas
Dese un punto de vista clínico es importante tener presente cual es el diagnostico principal del paciente. En el caso de que el niño esté diagnosticado de TEA, debemos de tener en cuenta que además de las estereotipias el paciente puede presentar otros tipos de movimientos anormales entre ellos los tics. Es importante por tanto diferenciar en la medida de lo posible ambos movimientos anormales. Algunas claves que nos pueden ayudar son la edad de inicio, la semiología del trastorno del movimiento, la constancia y carácter repetitivo de las estereotipias, la urgencia premonitoria, etc. (ver apartado de diagnóstico diferencial).48
4.1.4. Screening en consulta y diagnóstico
En los casos cuyo motivo de consulta sea el ST hay que tener en cuenta que la comorbilidad es muy elevada especialmente con TOC y TDAH. Como ya se ha comentado el porcentaje de pacientes con TS que presentan un diagnóstico de TEA oscila entre un 5 y un 15% y se debe de preguntar de forma activa acerca rasgos que orienten al TEA como la existencia de deficiencias en la comunicación e interacción social y patrones restrictivos y repetitivos de comportamiento, pero no hay que olvidar que con frecuencia los sujetos con TS asocian varios tipos de trastornos comórbidos además del TEA, fundamentalmente TOC y TDAH y que algunas conductas repetitivas pueden ser debidas al TOC, lo que obliga a ser prudente antes de llegar a un diagnóstico de TEA.
4.1.4. Tratamiento
Con respecto al tratamiento del paciente con autismo que presenta tics existen dos situaciones que hacen que haya que individualizar un poco el tratamiento. En primer lugar la terapia conductual – self monitoring habit-reserval training (HRT) y la exposure-response prevention (ERP) – van a presentar una dificultad adicional en niños con TEA que en muchas ocasiones pueden asociar discapacidad intelectual. El segundo aspecto que hay que tener en cuenta es que es habitual que nos encontremos con niños con tratamiento de base con neurolépticos – generalmente risperidona y aripripazol – por lo que ante la aparición de tics en estos niños la primera opción será añadir un α 2- adrenérgico – clonidina o guanfacina- . En principio no hay interacción conocida entre estos dos grupos de fármacos, los neurolépticos atípicos y los alfa-2-adrenérgicos por lo que esta asociación será la estrategia más realista.
Al igual que ocurre en el resto de pacientes afectos de ST con y sin TEA, si esta asociación farmacológica no funciona se deben intentar otras opciones farmacológicas como pueden ser la tetrabenazina, el baclofeno oral o el topiramato. Ninguno de ellos interacciona con los antipsicóticos. Por último no hay que olvidar que los factores estresantes exacerban tanto tics como estereotipias y que en la población con TEA los cambios en las rutinas y ambientales pueden ser un factor desencadenante por lo que es importante en la entrevista clínica tener en cuenta estos aspectos.
4.2. Trastorno por déficit de atención e hiperactividad
4.2.1. Definición y criterios diagnósticos
El Trastorno por déficit de atención e hiperactividad (TDAH), uno de los trastornos psiquiátricos más comunes en la infancia, se caracteriza por síntomas que incluyen la falta de atención, la hiperactividad y la impulsividad. 49 En base a la predominancia de estos síntomas, se clasifica en tres subtipos: TDAH hiperactivo/impulsivo, TDAH inatento y TDAH combinado. La asociación de TDAH con Síndrome de Tourette (ST) se reportó por primera vez en 1967 por Lucas AR et al., y luego en 1978 por Shapiro AK et al.50
Para hacer un diagnóstico de TDAH, los síntomas deben cumplir los criterios DSM-5 o de la CIE-10 y deben ser persistentes y estar asociados a un deterioro psicológico, social, familiar y/o educativo u ocupacional.51
Según el Manual Diagnóstico y Estadístico De Los Trastornos Mentales (DSM-5) este patrón persistente se caracteriza por 6 o más síntomas de inatención y/o 6 o más síntomas de hiperactividad-impulsividad que interfieren con el funcionamiento o el desarrollo (Criterio A). Además, estos síntomas deben estar presentes antes de los 12 años de edad (Criterio B), deben presentarse en dos o más contextos (ej. en casa, en la escuela o el trabajo, con amigos) (Criterio C), y existen pruebas claras de que los síntomas interfieren con el funcionamiento social, académico o laboral (Criterio D).
|
Inatención (6 o más)
|
Hiperactividad-Impulsividad (6 o más)
|
|---|
|
-Presta poca atención a los detalles
|
-Juguetea o golpea las manos o los pies
|
|
-Comete errores en tareas del colegio por descuido
|
-Se levanta en situaciones en las que se requiere permanecer sentado
|
|
-Tiene dificultad en mantener la atención en clases, conversaciones o lectura prolongada
|
-Corretea o trepa en situaciones en las que no se considera adecuado
|
|
-Parece no escuchar cuando se le habla
|
-Incapaz de jugar o entretenerse tranquilo en actividades recreativas
|
|
-No sigue las instrucciones y no termina las tareas escolares porque se distrae con facilidad
|
-Actúa “como si lo impulsara un motor”
|
|
-Tiene dificultad para organizar tareas y actividades
|
-Habla excesivamente
|
|
-Evita tareas que requieran un esfuerzo mental sostenido
|
-Termina las frases de otros, no respeta el turno de conversación
|
|
-Pierde cosas necesarias para tareas o actividades
|
-Le es difícil esperar su turno
|
|
-Se distrae con facilidad por estímulos externos
|
-Interrumpe o se inmiscuye con otros
|
|
-Olvida las actividades cotidianas
|
|
Adaptado de American Psychiatric Association., Kupfer, D. J., Regier, D. A., Arango López, C., Ayuso-Mateos, J. L., Vieta Pascual, E., & Bagney Lifante, A. (2014). DSM-5: Manual diagnóstico y estadístico de los trastornos mentales (5a ed.).
Frecuentemente, los síntomas de TDAH en niños con ST preceden en 2-3 años a la aparición de tics, siendo evidentes desde los 3 a 5 años de edad. Los síntomas del TDAH tienden a disminuir durante la adolescencia, de forma más tardía que los tics. En niños con ST y TDAH comórbido, existe una predominancia de comportamiento hiperactivo; siendo la presencia y severidad del TDAH un predictor importante de problemas de conducta y de asociación a otras comorbilidades.49
En un estudio multicéntrico con 6,805 pacientes con ST y TDAH (edad media de inicio de síntomas de TDAH: 6.1 años) se observó la siguiente distribución: TDAH combinado (51%), TDAH inatento (37%) y TDAH hiperactivo/impulsivo (7%), similar al perfil observado en población general52
4.2.2. Prevalencia
El TDAH es el trastorno psiquiátrico comorbido más frecuente en los niños con ST. Mientras que el TDAH tiene una prevalencia de hasta 5% en población pediátrica 49 en niños con ST se observa una prevalencia variable según la población estudiada comunitaria (30%-50%) vs. hospitalaria: (60-80%).50 A su vez, el 10.9%-20% de niños con TDAH presentan tics y ST comórbido53, 54. Es más probable que el niño o adolescente con ST y TDAH comórbido tenga historia familiar de TDAH (34% vs. 13%). La presencia de TDAH está asociada con un diagnóstico 3.5 años más temprano de ST. Sin embargo, no existe una diferencia significativa en el pico de edad de los tics en pacientes con ST con y sin TDAH comorbido52 Los niños con ST tienen más probabilidades de tener TDAH comórbido que las niñas (58.5% vs. 42.3%; p <0.01).55
4.2.3. Características clínicas
Los pacientes con ST y TDAH comórbido presentan alteraciones conductuales más frecuentemente que los pacientes sin TDAH comórbido en todas las edades.50 Esto se ha evidenciado en dos estudios amplios con más de 5000 individuos, donde se ha observado que el ST y TDAH comórbido se asoció con antecedentes familiares de TDAH y otras dificultades, incluyendo aumento del TOC, ansiedad (especialmente en niños y jóvenes), trastornos del sueño y desórdenes de control de la ira, dificultades específicas del aprendizaje, comportamientos autolesivos, trastornos de conducta, trastorno oposicionista desafiante y trastornos del estado de ánimo52, 56
Los niños con ST y TDAH comórbido presentan una alta tasa de otras comorbilidades asociadas. Así en el estudio de Freeman et al., el ST con TDAH comórbido “puro” se observó solo en el 18% de la muestra, mientras que se observó asociación con 1, 2 y 3 comorbilidades en el 34%, 28% y 13%, respectivamente52. Roessner et al., 2007 reportaron una tasa más alta de TOC (21% TDAH combinado vs. 11% TDAH inatento, diferencia no significativa) y de trastorno de ansiedad en niños (5-10 años) pero no en adolescentes (11-17 años) con ST y TDAH. También observaron una tasa más alta de trastornos del estado de ánimo en niños de cualquier edad con ST y TDAH comórbido 52, 56 Rizzo et al., 2017 también describe un porcentaje significativamente más alto de depresión (73% vs. 45%) en niños con ST y TDAH.57 La mayor parte los trastornos de conducta en niños con ST y TDAH están asociados con el subtipo de TDAH combinado o hiperactivo/impulsivo52
Erbilgin et al., 2018 estudiaron 54 niños y adolescentes con ST y TDAH comórbido y los compararon con un grupo similar de 54 niños con TDAH sin ST, observando una menor calidad de vida en el grupo de ST con TDAH comórbido.58
4.2.4. Screening en consulta y diagnóstico
El diagnóstico de TDAH debe realizarse con una evaluación clínica y psicosocial completa que incluya la historia del desarrollo y un análisis de la conducta en los diferentes ámbitos de la vida diaria (escuela, familia, ocio) del niño o adolescente. No se debe diagnosticar el TDAH basándose únicamente en escalas de evaluación o datos observacionales. No obstante, estas escalas son instrumentos validados útiles para valorar la gravedad, y aclarar dudas diagnósticas 51. Las escalas de screening y evaluación más utilizadas en el diagnóstico de TDAH son:
- Schedule for Affective Disorders and Schizophrenia for School Age Children Present and Lifetime Version DSM-5 (K-SADS-PL-5): entrevista semiestructurada que evalúa episodios actuales y pasados de psicopatología en niños y adolescentes de acuerdo con los criterios del DSM-5. Útil para evaluar comorbilidades.59
- Swanson , Nolan and Pelham questionnaire, 4a edición (SNAP-IV) : escala de screening y evaluación de TDAH. Es sensible a los cambios de tratamiento.
-Versión pediátrica del test de Conners ADHD Adult Rating Scales (CAARS): escala de screening que ofrece una mayor sensibilidad (92.3%) y especificidad (94.5%) para el diagnóstico de TDAH. La versión abreviada se compone de subescalas de oposicionismo, inatención , hiperactividad y el índice TDAH.
- Parents completed the Child Behavior Checklist (CBCL): cuestionario que ofrece una visión general de la conducta del individuo. Permite estudiar la conducta del niño y adolescente en todas sus dimensiones (problemas internalizantes, externalizantes, hiperactividad, impulsividad, obsesiones, ansiedad, etc.) lo que es útil en una patología compleja como el ST y sus comorbilidades.
-Estudio Neuropsicológico: permite evaluar el perfil cognitivo, las habilidades motoras, la atención, la memoria y las funciones ejecutivas49 así como es útil para descartar trastornos del aprendizaje54
Para determinar la significación clínica es importante tener en cuenta los puntos de vista de los niños y adolescentes, de los padres y valorar la información aportada por los maestros. Todas las partes deben estar correctamente informadas para explicar el diagnóstico, la gravedad de los síntomas, el plan de cuidados y cualquier necesidad educativa especial (logros y dificultades académicas, adaptación curricular) 51
4.2.5. Tratamiento
El tratamiento global del ST y el TDAH comórbido contempla intervenciones psicoeducativas, terapia cognitivo-conductual y fármacos.49
Cuando se decide indicar farmacoterapia, se pueden utilizar fármacos alfa-2 agonistas (clonidina, guanfancina), estimulantes (metilfenidato) o inhibidores de la recaptación de norepinefrina (atomoxetina). Rizzo et al describieron un algoritmo terapéutico en niños con ST y TDAH teniendo en cuenta la seguridad y eficacia sugiriendo el uso de alfa-2 agonista como tratamiento de primera línea, y el uso de estimulantes como segunda línea o como primera en caso de niños que requieran una mejoría inmediata de los síntomas de TDAH. También recomiendan la asociación de ambos fármacos (alfa-2 agonistas y estimulantes) en pacientes donde el tratamiento en monoterapia no haya mostrado ninguna eficacia significativa después de un largo período de tiempo enfermedad y el uso de agonistas parciales de la dopamina (aripiprazol) en pacientes con ST y TDAH leve.53
Existe evidencia de la eficacia de los fármacos noradrenergicos en el tratamiento del TDAH en pacientes con Síndrome de Tourette. Los fármacos alfa 2 adrenérgicos, clonidina y guanfacina, han demostrado en varios estudios clase I frente a placebo, ser eficaces en el manejo de los síntomas de TDAH proporcionando una mejoría significativa en el trastorno de tics (recomendación A).60, 61 Mientras que guanfacina presenta la indicación en ficha técnica como tratamiento de segunda línea del TDAH, clonidina aún no presenta dicha indicación. Ambos presentan un buen perfil de seguridad, aunque la frecuencia e intensidad de efectos adversos es menor en el caso de guanfacina.
El metaanálisis de Hollis recoge los datos de varios RCT (estudios Clase I) que demuestran la eficacia y seguridad de metilfenidato y dexmetilfenidato en el tratamiento de los síntomas de TDAH en pacientes con síndrome de Tourette sin objetivarse empeoramiento de los tics en estos pacientes (recomendación A), si bien tampoco se ha reportado una mejoría de los mismos.60 Por su parte, otros autores concluyen que los fármacos estimulantes no empeoran los tics y resultan eficaces en el tratamiento del TDAH en pacientes con síndrome de Tourette60, 61
Hay que considerar que los fármacos estimulantes pueden exacerbar los síntomas del trastorno obsesivo-compulsivo, por lo que se recomienda en caso de coexistir, iniciar el tratamiento con un inhibidor selectivo de la recaptación de serotonina primero, para luego abordar el manejo del TDAH. Esto teniendo en cuenta que algunos síntomas de TDAH puedan deberse al TOC y ser diagnosticados erróneamente como debidos al TDAH.62
Por su parte, atomoxetina, inhibidor de la recaptación de noradrenalina, indicado como fármaco de segunda línea en el tratamiento de TDAH, ha demostrado ser eficaz frente a placebo (estudio Clase I) en la reducción de tics en pacientes con TDAH asociado a Síndrome de Tourette (recomendación B).56, 57
Otro tratamiento estudiado como la desipramina puede ser efectiva en la reducción de los tics y en el control de los síntomas del TDAH (estudio Clase I, nivel B).60Según este estudio (clase IV) aripiprazol podría ser eficaz en el control de los tics y de los síntomas del TDAH comórbido con un nivel de recomendación C.60
4.3. Trastornos del aprendizaje
4.3.1. Definición y criterios diagnósticos
Según el Manual Diagnóstico y Estadístico De Los Trastornos Mentales (DSM-5), los trastornos de aprendizaje se definen como la dificultad en el aprendizaje y en la utilización de las aptitudes académicas, evidenciado por la presencia de al menos uno de los siguientes síntomas que han persistido por lo menos durante 6 meses, a pesar de intervenciones dirigidas a estas dificultades: (1) Lectura de palabras imprecisa o lenta y con esfuerzo (ej., lee palabras sueltas en voz alta incorrectamente o con lentitud y vacilación, con frecuencia adivina palabras, dificultad para expresar bien las palabras); (2) Dificultad para comprender el significado de lo que lee (p.ej., puede leer un texto con precisión pero no comprende la oración, las relaciones, las inferencias o el sentido profundo de lo que lee); (3) Dificultades ortográficas (p. ej., puede añadir, omitir o sustituir vocales o consonantes); (4) Dificultades con la expresión escrita (p. ej., hace múltiples errores gramaticales o de puntuación en un oración; organiza mal el párrafo; la expresión escrita de ideas no es clara); (5) Dificultades para dominar el sentido numérico, los datos numéricos o el cálculo (p. ej., comprende mal los números, su magnitud y sus relaciones; cuenta con los dedos para sumar números de un solo dígito en lugar de recordar la operación matemática como hacen sus iguales; se pierde en el cálculo aritmético y puede intercambiar los procedimientos); (6) Dificultades con el razonamiento matemático (p. ej., tiene gran dificultad para aplicar los conceptos, hechos u operaciones matemáticas para resolver problemas cuantitativos).
Además, las aptitudes académicas afectadas están sustancialmente y en grado cuantificable por debajo de lo esperado para la edad cronológica del individuo, e interfieren significativamente con el rendimiento académico o laboral, o con actividades de la vida cotidiana, que se confirman con medidas (pruebas) estandarizadas administradas individualmente y una evaluación clínica integral.
Las dificultades de aprendizaje comienzan en la edad escolar pero pueden no manifestarse totalmente hasta que las demandas de las aptitudes académicas afectadas superan las capacidades limitadas del individuo (p. ej., en exámenes programados, la lectura o escritura de informes complejos y largos para una fecha límite inaplazable, tareas académicas excesivamente pesadas). Éstas dificultades no se explican mejor por discapacidades intelectuales, trastornos visuales o auditivos no corregidos, otros trastornos mentales o neurológicos, adversidad psicosocial, falta de dominio en el lenguaje de instrucción académica o directrices educativas inadecuadas.
4.3.2. Screening en consulta y diagnóstico
Para poder diagnosticar un trastorno de aprendizaje se han de cumplir los cuatro criterios diagnósticos expuestos en el apartado anterior basándose en una síntesis clínica de la historia del individuo (del desarrollo, médica, familiar, educativa), informes escolares y evaluación psicoeducativa. Se especificará si se trata de un Trastorno específico del Aprendizaje con dificultades en la lectura, con dificultad en la expresión escrita o con dificultad matemática. Asimismo, también se especificará la gravedad actual, indicando si se trata de leve (puede compensar las dificultades con la adaptación adecuada), moderado (precisa de una enseñanza intensiva y especializada) o grave (precisan de una enseñanza constante e intensiva individualizada y especializada durante la mayor parte de los años escolares).
4.3.3. Prevalencia
Se ha descrito que los niños con ST tienen tendencia a presentar dificultades a nivel escolar y académico. Por un lado, algunas vienen derivadas directamente de los síntomas mismos de trastorno, por ejemplo el tiempo que dedican a reproducir el tic o a contenerlo puede interferir en la concentración y la capacidad atencional durante las clases. Por otro lado, el ST ha sido asociado a déficits neuropsicológicos que afectan por ejemplo a la memoria de trabajo, a la psicomotricidad fina y a la integración visomotora, repercutiendo en el rendimiento académico.63 Entre el 16-27%, de los pacientes con ST tienen algún tipo de dificultad en el aprendizaje.50 En este sentido, es difícil poder diferenciar si las dificultades en el aprendizaje son secundarias a la fisiopatología y la afectación neuropsicológica del ST en sí, o se tratan de un trastorno del aprendizaje comórbido e independiente del ST.
La principal dificultad en los aprendizajes en el ST es debida a las alteraciones en la integración visomotora, lo que conlleva problemas en la expresión escrita (dificultades al copiar de la pizarra, necesidad de más tiempo en completar ejercicios escritos largos, errores al deletrear y en la presentación).
Las dificultades en la lectoescritura y en el aprendizaje descritas pueden verse agravadas en los niños con ST que sufren TDAH de manera comórbida. 50, 53
En esta línea, hay diversos estudios que objetivan mayor riesgo de experimentar fracaso y abandono escolar en pacientes con ST, comparado con la población general.64, 65Recientemente se han publicado estudios epidemiológicos en población sueca en los que se concluye que pacientes con ST obtienen peores resultados académicos a largo plazo comparado con sus iguales: 65% menos posibilidades de completar la educación secundaria, 59% menos posibilidades de entrar en la universidad y 61% menos posibilidades de acabar estudios universitarios. Así, se ha objetivado que las personas con ST pueden padecer una afectación en su funcionalidad académica.64
4.3.4. Tratamiento
Se pueden realizar diferentes adaptaciones en el medio escolar y también en casa para compensar las dificultades que presentan. Por ejemplo, para superar las dificultades en la escritura: (1) Reducir los deberes o ejercicios escritos: simplificando el enunciado, disminuyendo el número de ejercicios, preguntando oralmente; (2) Facilitar que un compañero sin estas dificultades le pueda proporcionar sus apuntes para comparar y completar; (3) Dejar más tiempo en los exámenes y dar un margen de error amplio en los fallos de ortografía. Para dar soporte en los trastornos de aprendizaje centrados en el procesamiento del lenguaje, se podría proporcionar información visual a la vez que la auditiva si es posible, a través de gráficos o dibujos, y dar instrucciones de una en una, claras y concisas.
4.4. Trastorno Obsesivo Compulsivo (TOC)
4.4.1. Definición y prevalencia
El ST mantiene una relación muy directa con el TOC y en algunos niños es difícil demarcar los límites clínicos de cada uno. Se han descrito series en las que hasta el 80% de los pacientes con ST puede presentar TOC a lo largo de la vida.66 Las obsesiones se definen como pensamientos o imágenes intrusivas que provocan ansiedad y que se repiten aunque la persona trate de ignorarlas o suprimirlas, y las compulsiones como actos o rituales mentales repetitivos que la persona siente que ha de llevar a cabo y que ayudan a reducir la ansiedad provocada por una obsesión. Los tics también son movimientos repetitivos, pero la sensación que los precede es de diferente naturaleza que la propia de las obsesiones, y se explica mejor como una tensión física premonitoria. Esta distinción no siempre es fácil de realizar y a menudo estas conductas repetitivas que son difíciles de catalogar se encuadran en el llamado espectro “tic compulsivo”. 66
4.4.2. Características clínicas
En la actualidad el DSM-5 incluye un subtipo para el TOC relacionado con tics, para aquella presentación que está precedida de un trastorno por tics. El TOC comórbido al ST difiere en algunas cosas del TOC puro, suele tener una edad de inicio más temprana, es más frecuente en chicos y se suele asociar más con el diagnóstico de TDAH, otros trastornos de conducta, tricotilomania y dismorfofóbia. También se diferencian en el tipo de obsesiones, en los pacientes con tics es frecuente presentar obsesiones de tipo agresivo, sexual, religioso y de simetría y orden, así como contar, ordenar, tocar, almacenar o compulsiones auto-destructivas. Sin embargo, el período de mayor exacerbación de los síntomas obsesivo-compulsivos suele ocurrir dos años después del momento en el que se da la exacerbación de tics. Muchas veces estos síntomas obsesivos se llevan en secreto y se evidencian más en el entorno familiar. Con el tiempo, pueden evolucionar a afectación de la adaptación familiar y depresión.67
4.4.3. Screening en consulta y diagnóstico
En la actualidad el DSM-5 incluye un subtipo para el TOC relacionado con tics, para aquella presentación que está precedida de un trastorno por tics. La evaluación del niño debe hacerla un especialista en este campo para diferenciar los tics de las compulsiones. A veces en niños pre púberes se hace difícil la descripción de obsesiones y las preguntas tienen que ser muy dirigidas o hacerse a la familia. El diagnóstico se realiza mediante la anamnesis, basándose en síntomas que describa el paciente o sus padres. Muchas veces los pacientes ocultan voluntaria o involuntariamente información y el diagnóstico tiende a diferirse en el tiempo, cosa que agrava el pronóstico del trastorno. Respecto a las preguntas de cribado, la “checklist” de la escala Children-Yale-Brown Obsessive Compulsive Scale (CY-BOCS)68 para trastornos obsesivos compulsivos puede servir de guía al clínico en lo que refiere a preguntas concretas a realizar.
4.4.4. Tratamiento
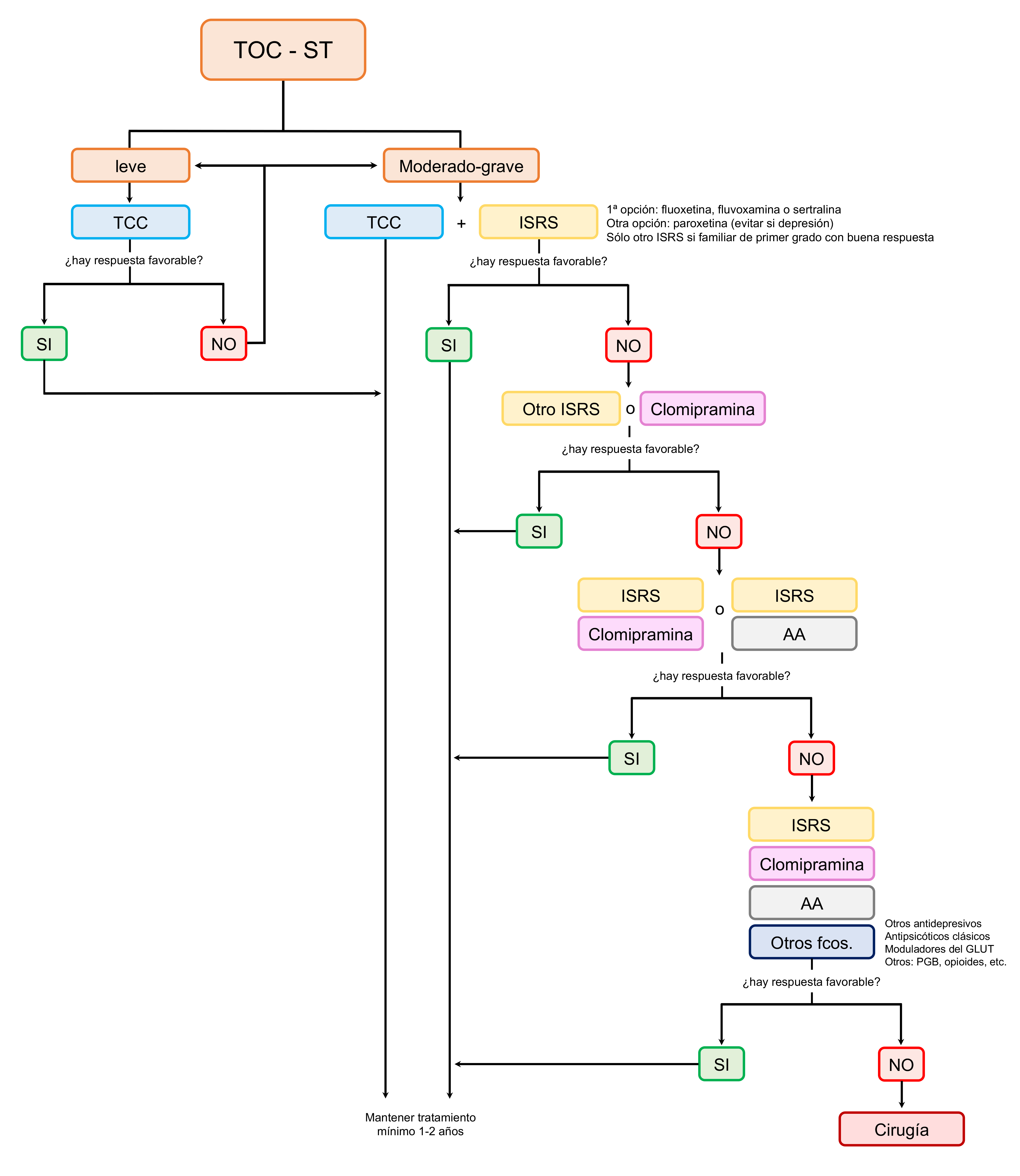
Tanto la psicoterapia como la terapia farmacológica han demostrado ser eficaces en el tratamiento del TOC en pediatría. El estudio de tratamiento del TOC pediátrico (POTS), un RCT multicéntrico que incluye 112 pacientes con edades comprendidas entre 7-17 años con diagnóstico de TOC, ha evaluado la eficacia y seguridad de las diferentes terapias disponibles para el tratamiento de este trastorno y el impacto de las mismas en los tics.61Según este estudio, el manejo del TOC comórbido no difiere del TOC sin tics asociados aunque la eficacia de la medicación en los pacientes con TOC en el contexto de un síndrome de Tourette es menor que en aquellos pacientes con TOC sin Tourette61. La primera línea de tratamiento es la terapia de exposición y prevención del ritual (ERP) (recomendación A). Cuando no es posible llevar a cabo ERP, ya que requiere de psicólogos especializados en la aplicación de la misma, se recomienda el uso de fármacos, fundamentalmente los inhibidores selectivos de la recaptación de serotonina (ISRS), que son los que cuentan con mayor evidencia en cuanto a eficacia y seguridad en pacientes pediátricos (recomendación A). 61 Los fármacos recomendados de primera línea según los estudios serían: fluoxetina, fluvoxamina, sertralina o clomipramina.61. Fluoxetina ha demostrado mejorar la sintomatología del TOC en pacientes con síndrome de Tourette no mostrando ningún efecto sobre los tics (recomendación A).60 Existe poca evidencia de que otros fármacos usados en el tratamiento del síndrome de Tourette, como los antipsicóticos (risperidona, aripiprazol) tengan efectos sobre la sintomatología del TOC, aunque no parecen empeorarla.69
4.5. Trastornos de ansiedad
4.5.1. Definición y prevalencia
Los trastornos de ansiedad (TA) se caracterizan por miedos y preocupaciones irracionales que impiden al niño que las presenta realizar algunas de las actividades diarias. En niños y adolescentes existen tres tipos básicos de TA: el TA por separación, el TA generalizado y la fobia social que en los menores se suele expresar como fobia escolar.
La prevalencia de TA comórbidos es elevada en los menores con tics y con ST. Estudios tanto realizados en población general70 como en población clínica71 han mostrado elevadas tasas de prevalencia, aunque algunos de estos estudios se han basado solo en puntuaciones de escalas auto administradas sin confirmación clínica del diagnóstico. El mayor estudio reciente con más de 1000 pacientes diagnosticados de ST, detectó una prevalencia a lo largo de la vida del 36% de trastornos de ansiedad en pacientes con TS55, dato que ha sido confirmado por otro estudio en el 2018 centrado en pacientes pediátricos con ST que encontró tasas de comorbilidad del 20-30%, siendo el más frecuente el TA generalizada en adolescentes y el TA por separación en niños más pequeños72.
4.5.2. Características clínicas
Algunos estudios han demostrado correlación entre los síntomas de ansiedad y la intensidad de los tics en pacientes con ST71. Otro dato significativo es que los pacientes con ST y con TA asociado, tienen mayor prevalencia de TOC comórbido.
4.5.3. Screening en consulta y diagnóstico
El diagnóstico del TA debe hacerse mediante una anamnesis sistemática, y es importante saberla distinguir de los miedos y preocupaciones considerados normales en algunas etapas del neurodesarrolllo. Para alcanzar la categoría diagnóstica de trastorno debe detectarse mayor intensidad y frecuencia de los síntomas de los que se consideran típicos en cada fase del desarrollo, por ello el diagnóstico debe hacerlo un psiquiatra o pediatra con experiencia. En pacientes con ST, la presencia de tics suele agravar las preocupaciones cognitivas y evitaciones ansiosas relacionadas con los tics. En cuanto a las herramientas de cribaje, la escala MASC (Multidimensional Anxiety Scale for Childre; March, 1997) o SCARED (Screen for Child Anxiety Related Emotional Disorder, Birmaher et al., 1999), ambas validadas en lengua española pueden ayudar al diagnóstico.
4.5.4. Tratamiento
Los tratamientos de elección son de tipo psicológico, y los que han mostrado mayor evidencia aquellos que se engloban dentro de la terapia cognitivo-conductual que utilizan la relajación y la exposición progresiva a estímulos ansiógenos. En casos más graves también se ha demostrado eficacia de los tratamientos combinados con inhibidores de la recaptación de serotonina como la sertralina.
4.6. Trastornos afectivos
4.6.1. Definición y prevalencia
Los trastornos afectivos afectan entre el 13-76% de los pacientes diagnosticados de ST, siendo el trastorno depresivo mayor el diagnóstico más frecuente y el factor predictor más sólido de ingreso hospitalario. La depresión en niños y adolescentes está caracterizada por tristeza, pérdida de la capacidad de disfrutar y tener interés por actividades que siempre habían motivado al paciente, cambios en los patrones de sueño y hábitos alimentarios, así como pensamientos relacionados con la muerte. En los niños pre púberes un síntoma frecuente es la irritabilidad, mientras que en los adolescentes es más evidente la tristeza y la rabia. Cuando los síntomas depresivos se prolongan a lo largo de dos semanas o más tiempo y tienen una entidad relevante se consideran diagnóstico de Trastorno depresivo. Este trastorno se caracteriza por síntomas depresivos asociados a deterioro funcional que es episódico, y la duración media de un episodio no tratado suele ser de nueve meses. La distimia representa el trastorno depresivo leve o moderado más cronificado y requiere que los síntomas se prolonguen por más de un año.
4.6.2. Características clínicas
Es importante distinguir en los pacientes con tics lo que es un trastorno depresivo franco, de lo que podría llamarse “desmoralización”. Los niños con ST asociado a comorbilidades tienen importantes dificultades que se asocian a cierta desmoralización adaptativa. Incluso, aquellos que tienen más conciencia de sus dificultades son los más propensos a este ánimo debido a la frustración que sienten en relación a su incompetencia para controlar los tics o en las interacciones sociales. Los pacientes desmoralizados mejoran cuando lo hacen sus síntomas relacionados con el ST o cuando son emplazados en ambientes más protectores.73
4.6.3. Screening en consulta y diagnóstico
El diagnóstico es también clínico y debe realizarse a través de una anamnesis completa. El cribado de síntomas depresivos, así como de ideación suicida asociada a ellos es importante en todos los pacientes diagnosticados con ST y especialmente en adolescentes, en pacientes con comorbilidad de TOC y/o TA, así como aquellos que hayan sido víctimas de acoso escolar. Los pacientes con trastornos depresivos tienen un humor cualitativamente más afectado, suelen estar más anhedónicos, se sienten muy desgraciados más que tristes y no manifiestan mejoría, ni un humor más reactivo en ambientes más acogedores. Además suelen presentar síntomas neurovegetativos como alteraciones del sueño y del hambre. Como instrumento de cribado puede utilizarse el CDI (Children’s Depression Inventory, Kovacs 2001). Aquellos con un punto de corte mayor a 16 deberían ser evaluados por un clínico entrenado en el diagnóstico para confirmar el diagnóstico clínico.
4.6.4. Tratamiento
Dado que no hay estudios específicos que determinen la eficacia del tratamiento en pacientes pediátricos con ST y trastornos afectivos, el tratamiento estándar es el mismo que el de los pacientes con depresión. En casos leves o moderados la terapia psicológica cognitivo conductual o interpersonal es la que ha mostrado más eficacia y en casos moderados y graves la asociación de tratamiento farmacológico .73 50
4.7. Rage attacks o Explosiones de rabia
4.7.1. Definición y prevalencia
Las explosiones de rabia están caracterizadas por manifestaciones de violencia verbal o física exageradas e impredecibles, desproporcionadas en relación al estímulo que las ha motivado y que muchas veces comportan riesgo de auto lesionarse o agredir a objetos o personas. Estas explosiones son una de las manifestaciones más frecuentes por las que consultan los pacientes con ST a psiquiatría. Se calcula que al menos el 25% de los pacientes con ST que se derivan a consulta con Psiquiatría presentan estas alteraciones, y muchos de estos pacientes acaban requiriendo tratamiento en régimen de ingreso o residencial.
4.7.2. Características clínicas
Típicamente estos estallidos conductuales tienen una naturaleza explosiva y se acompañan de una alta carga emocional, así como de activación autonómica. El ataque tiene un inicio súbito, alcanza rápidamente un pico y se suele acompañar de una sensación subjetiva de pérdida de control. Una sensación de aumento de la tensión interna o hiperactivación puede preceder al episodio. Se diferencian de los berrinches temperamentales por su magnitud y por las consecuencias destructivas contra objetos o personas que tienen en muchas ocasiones. Aunque estos episodios pueden ocurrir en ausencia de desencadenantes claros, algunos coinciden con deprivación de sueño, consumo de tóxicos o pequeñas frustraciones, y en general no forman parte del temperamento del individuo. En general suelen ser episodios que duran de minutos a una hora, y muy ocasionalmente pueden ser más largos. Suelen ser mucho más frecuentes en el ambiente familiar donde el paciente tiene más confianza que en contextos sociales o escolares. Con frecuencia la sucesión de estos episodios lleva a un deterioro del ambiente familiar, cierta desmoralización y sentimientos de baja autoestima por parte del paciente que los sufre y a la larga dificultad de funcionamiento en otras aéreas 70
4.7.3. Screening en consulta y diagnóstico
Pocas escalas auto administradas se han demostrado eficaces para detectar esta comorbilidad que se suele corresponder con diferentes diagnósticos (Trastorno explosivo intermitente, Trastorno negativista desafiante). La escala State-Trait Anger Expression Inventory (STAXI) en adolescentes o el Parents completed the Child Behavior Checklist (CBCL) administrado a padres pueden aportar información al respecto y constan de muchos ítems que se relacionan con la agresividad y las alteraciones conductuales provocadas por los episodios de ira. La presencia de estos episodios es más frecuente cuando se asocian comorbilidades como el TDAH, trastornos de aprendizaje el TOC y los trastornos de ansiedad y los trastornos depresivos74.
4.7.4. Tratamiento
Aunque algunas intervenciones de tipo conductual se han mostrado eficaces en el tratamiento de estos episodios, suele ser necesario el tratamiento con bajas dosis de antipsicóticos como risperidona o aripiprazol. También se deben contemplar como parte del tratamiento, los programas de entrenamiento de padres en pautas conductuales.
4.8. Aspectos psicosociales
El ST es un trastorno complejo y heterogéneo que puede generar limitaciones importantes a nivel emocional, social y educativo. En los casos en los que predominan los tics severos, el paciente puede verse afectado físicamente por el dolor que causan (contracturas, lesiones), o emocionalmente por el impacto que puede tener a nivel social la presencia de tics fónicos complejos (coprolalia, ecolalia, vocalizaciones inapropiadas). En otros casos, los tics pueden ser más leves, pero las comorbilidades como el TDAH, el TEA o las dificultades en los aprendizajes pueden suponer una limitación social y académica importante47, 53 A nivel escolar, el comportamiento impulsivo, el trastorno de conducta o los ataques de rabia generan rechazo por parte de iguales. En una cohorte clínica de 103 pacientes con ST (adolescentes y adultos) Elstner et al., reportaron que el 29% presentaban conflicto y deterioro familiar, un 27% manifestaban dificultad importante en hacer amigos y un 20% referían un bajo funcionamiento social.75
Por todo lo mencionado, el paciente con ST parece ser alguien muy vulnerable a sufrir aislamiento y acoso escolar o bullying. A veces los pacientes con mayor conciencia de enfermedad son los que más frustración sufren por no conseguir controlar los síntomas, lo que conlleva mayor sentimiento de rabia y baja autoestima, desmoralización y síntomas depresivos. Todo ello se suma a la propia adolescencia, que en sí constituye una época vulnerable a los conflictos interpersonales, creándose un círculo vicioso difícil de frenar.76
El manejo de los aspectos psicosociales es crucial en la evolución y pronóstico de la enfermedad. Es necesario realizar un abordaje de las familias de los niños con ST puesto que sufren de sentimientos de culpa, frustración y ello puede afectar a la parentalidad. Los grupos psicoeducativos, los programas de entrenamiento a padres y la individualización de cada caso puede ser útil. Además, el asesoramiento a los profesores es crucial para mejorar el funcionamiento académico y social76. Ello incluye explicar el trastorno a los compañeros y al equipo docente para mantener una actitud de aceptación y lo más flexible posible con el niño, realizar adaptaciones curriculares si hay dificultades en los aprendizajes, fomentar la aceptación a la diversidad y los programas anti-bullying, destacar los factores de resiliencia (deporte, música, hobbies y actividades que le gustan y se le dan bien), mejorar la autoestima y dar herramientas a los profesores, padres y al propio niño para adaptarse al medio.
5 - Abordaje terapéutico
El manejo terapéutico del síndrome de Tourette en la edad pediátrica es fundamentalmente sintomático y tiene como objetivo prevenir o minimizar los efectos deletéreos de los tics y de los trastornos comórbidos asociados (trastorno por déficit de atención e hiperactividad (TDAH), trastorno obsesivo compulsivo (TOC), etc,) tanto a nivel físico (dolor, contracturas, lesiones y heridas físicas) como emocional (ansiedad, depresión, problemas de a autoestima) prestando especial atención en la repercusión del trastorno en la calidad de vida del paciente, en la interferencia en su vida familiar y escolar o en las relaciones sociales, más que en el propio control completo de los tics.
El tratamiento debe iniciarse proporcionando al paciente y a la familia información detallada sobre la enfermedad: en qué consiste, cuál es la evolución y pronóstico esperados, que comorbilidades puede asociar; dejando claro cuál es el objetivo terapéutico y las herramientas con las que se cuentan de una manera personalizada. Existen dos tipos de intervenciones fundamentales: (1) las terapias cognitivas, donde el entrenamiento en reversión de hábitos y la intervención global de comportamiento para tics (HRT/CBIT) han demostrado los mejores resultados; y (2) el tratamiento farmacológico fundamentado en el uso de fármacos alfa-2 adrenérgicos y antipsicóticos. En casos graves refractarios al tratamiento convencional se están ensayando otras terapias como la neuromodulación.
Al evaluar el nivel de evidencia existente en la literatura de cada uno de los tratamientos disponibles para el síndrome de Tourette en la edad pediátrica, nos encontramos con numerosas limitaciones: existen escasos ensayos clínicos para cada tipo de intervención, además el tamaño muestral suele ser pequeño y en ocasiones los estudios se realizan con mezcla de pacientes pediátricos y adultos. La mayoría de los estudios son de baja calidad, lo que reduce la fuerza de las conclusiones (certeza moderada, baja o muy baja en la estimación del efecto). Además, algunos tratamientos (neuromodulación) se han ensayado casi exclusivamente en adultos y en niños sólo encontramos casos clínicos aislados o series reducidas de casos. Por otra parte, los ensayos clínicos están diseñados para valorar efectos a corto plazo y no contamos con estudios sobre el efecto a largo plazo, no teniendo en cuenta la naturaleza fluctuante de los tics ni el efecto de la intervención sobre las comorbilidades. Por todo esto, la mayoría de los fármacos utilizados en pediatría para el tratamiento del síndrome de Tourette se prescriben fuera de indicación ya que en general no se contempla este uso en la ficha técnica del producto. Esto hace que la decisión terapéutica pueda ser complicada y con frecuencia se recurra al “ensayo y error”.
En este capítulo, vamos a exponer la evidencia disponible hasta la fecha en el tratamiento del síndrome de Tourette en la edad pediátrica y en base a esto, cuáles serían las recomendaciones terapéuticas.
5.1. Metodología
Para evaluar la evidencia científica existente de las diferentes intervenciones utilizadas en el tratamiento del síndrome de Tourette se ha realizado una búsqueda sistemática en las principales bases bibliográficas de literatura científica PUBMED, COCHRANE, EMBASE, OVID, y se han seleccionado las publicaciones realizadas en los últimos 5 años acerca del tratamiento del síndrome de Tourette en pediatría. Se han considerado los estudios realizados en edad pediátrica y los estudios mixtos realizados en población infantil y adulta, incluyendo artículos de revisión, meta-análisis, ensayos clínicos aleatorizados, estudios abiertos, series de casos, consenso de expertos y guías clínicas publicadas con anterioridad. Un grupo de trabajo formado por tres neuropediatras expertos en el manejo y tratamiento del síndrome de Tourette ha evaluado la calidad de las publicaciones y la evidencia científica de los estudios incluidos en las mismas, para finalmente, en base a las conclusiones obtenidas elaborar las recomendaciones de tratamiento que se describen en este capítulo.
5.2. Análisis de la variabilidad, fiabilidad y validez de los artículos
Para evaluar los estudios publicados hemos analizado los niveles de evidencia siguiendo como principal referencia la metodología de la AAN (American Academy of Neurology, 2006): Clasificación de los estudios clínicos AAN, American Academy of Neurology (2006).
Clase I. Estudio clínico aleatorizado controlado (RCT), de una intervención de interés, con resultados enmascarados o con evaluación objetiva, en una población representativa. Las características relevantes basales entre los dos grupos de tratamiento se presentan y son sustancialmente equivalentes o hay un ajuste estadístico apropiado si se presentaran diferencias. Las siguientes condiciones también deben satisfacerse:
- Ocultamiento de la asignación.
- Clara definición del (los) resultado(s) principal(es).
- Clara definición de los criterios de inclusión y exclusión.
- Adecuada descripción de pérdidas de pacientes (al menos el 80% de los sujetos deben completar el estudio) y de cruzamientos con números suficientemente bajos como para tener un potencial mínimo de sesgo.
- En caso de ensayos clínicos de no inferioridad o equivalencia que buscan probar la eficacia de una o las dos medicaciones evaluadas, se requieren también los siguientes requisitos*:
- El tratamiento estándar que se utiliza en el estudio es sustancialmente similar al utilizado en los estudios previos para establecer la eficacia del tratamiento estándar (por ejemplo, para un fármaco, el modo de administración, la dosis y los ajustes de dosificación son similares a los que han demostrado ser eficaces previamente).
- Los criterios de inclusión y exclusión para la selección de los pacientes y los resultados de los pacientes en el tratamiento estándar son sustancialmente equivalentes a los de los estudios previos que establecen la eficacia del tratamiento estándar.
- La interpretación de los resultados del estudio se basa en el análisis de casos observados.
Clase II. Estudio clínico aleatorizado controlado, de una intervención de interés, con resultados enmascarados o con evaluación objetiva, en una población representativa, que carezca de una de las características a-e de la Clase I, o un estudio de cohorte prospectivo apareado con resultados enmascarados o con evaluación objetiva, en una población representativa, que cumpla las características b-e de la Clase I. Las características relevantes basales entre los dos grupos de tratamiento se presentan y son sustancialmente equivalentes o hay un ajuste estadístico apropiado si se presentaran diferencias.
Clase III. Todos los otros estudios controlados (incluyendo controles de historia natural bien definidos o pacientes utilizados como su propio control) en una población representativa, donde el desenlace sea independientemente evaluado o independientemente derivado por medición objetiva del mismo.
Clase IV. Estudios que no cumplan los criterios de las Clases I, II o III, incluyendo consenso u opinión de expertos.
Grados de recomendación: Tenga en cuenta que las recomendaciones pueden ser positivas o negativas.
A Establecido como eficaz, ineficaz o perjudicial para la condición dada en la población especificada. Requiere al menos dos estudios Clase I.
B Probablemente eficaz, ineficaz o perjudicial para la condición dada en la población especificada. Requiere un estudio Clase I o dos estudios Clase II consistentes.
C Posiblemente eficaz, ineficaz o perjudicial para la condición dada en la población especificada. Requiere un estudio Clase II o dos estudios Clase III consistentes.
U Datos inadecuados o contradictorios; dado el conocimiento actual, el tratamiento no está comprobado. Estudios que no cumplen los criterios de la Clase I a la Clase III.
5.3. Protocolo de abordaje farmacológico
El tratamiento farmacológico en el síndrome de Tourette está encaminado a minimizar los síntomas y la discapacidad resultante del trastorno de tics y de sus comorbilidades asociadas y su principal indicación en la edad pediátrica es el tratamiento de aquellos pacientes con una afectación moderada-grave medida en las escalas, que presenten algún grado de discapacidad y en los que o bien no se puedan aplicar terapias cognitivas con demostrada eficacia (HRT/CBIT) o éstas no han resultado eficaces77.
Los fármacos de los que disponemos en la actualidad, sin embargo, no han sido desarrollados inicialmente para el tratamiento de los tics, sino que se trata de fármacos ideados para el tratamiento de otras enfermedades y que posteriormente han demostrado su eficacia en el tratamiento del síndrome de Tourette60. Entre los grupos farmacológicos más usados se encuentran los fármacos antipsicóticos, los alfa-2-adrenérgicos, fármacos antiepilépticos, agonistas dopaminérgicos, inhibidores de la recaptación de monoaminas, inhibidores de la recaptación de serotonina, antidepresivos y agonistas gabaérgicos entre otros.
5.3.1 Alfa-2 adrenérgicos
Los agonistas alfa-2 adrenérgicos, clonidina y guanfacina, son los fármacos considerados como primera línea de tratamiento farmacológico en algunas guías de práctica clínica del síndrome de Tourette en la edad pediátrica debido a su demostrada eficacia y perfil de efectos adversos más favorable en comparación con los fármacos antipsicóticos (recomendación A).60, 69, 78. Presentan acción simpaticomimética y se han utilizado ampliamente en el tratamiento de la hipertensión arterial, así como en el tratamiento de segunda línea en el TDAH, habiendo demostrado una reducción significativa de los tics en este último grupo de pacientes, aunque estudios posteriores han demostrado que también resultan eficaces en el tratamiento de los tics en pacientes sin TDAH. Entre sus efectos adversos más frecuentes se encuentran: hipotensión, ortostatismo, bradicardia, irritabilidad, sedación y alteración del sueño, por lo que se recomienda la escalada gradual de dosis para minimizar su incidencia y de la misma manera la retirada del fármaco debe realizarse de manera gradual.
Varios ensayos randomizados controlados (RCT) han demostrado la eficacia de clonidina vía oral frente a placebo en el tratamiento del síndrome de Tourette en niños y adolescentes (recomendación A) con un tamaño de efecto moderado-grande en cuanto a reducción global de tics, así como mejoría del grado de discapacidad y mejores puntuaciones en la escala de evaluación global, aunque con mayor tasa de efectos adversos que placebo, siendo el más frecuente la sedación).60, 69, 78 También se ha evaluado la eficacia de los parches de clonidina en al menos dos RCT frente a placebo (Clase I) y aunque, si bien, la tasa de efectos adversos era similar en ambos grupos, los parches de clonidina no demostraron eficacia en la reducción de tics ni en la disminución del grado de discapacidad 60
Guanfacina es un agonista selectivo alfa-2 adrenérgico con los mismos efectos que clonidina pero con mejor perfil de efectos secundarios debido a su acción más selectiva a nivel de sistema nervioso central.60 La guanfacina de liberación prolongada tiene como indicación fundamental en pediatría el tratamiento de segunda línea en el trastorno por déficit de atención e hiperactividad y presenta efectos similares a clonidina en el control de los tics. Se han publicado al menos dos RCT con placebo (clase I) en población pediátrica que demuestran reducción global de los tics en las escalas así como mejoría global y del grado de discapacidad con el uso de guanfacina (recomendación A) , proporcionando un tamaño de efecto grande y pocos efectos adversos de carácter leve.60 78
5.3.2 Antipsicóticos
Los fármacos antipsicóticos actúan como antagonistas de los receptores dopaminergicos D2. Se han utilizado desde hace varias décadas en el tratamiento del síndrome de Tourette en niños y adolescentes siendo los fármacos mejor estudiados60, 69, 78
Los estudios publicados hasta la fecha (clase I) demuestran que los antipsicóticos presentan un tamaño de efecto medio-grande en la reducción de los tics a corto plazo en población pediátrica con síndrome de Tourette así como un descenso en el grado de discapacidad medido en las escalas con un nivel de recomendación A. 60, 69, 78 Así mismo, no se han encontrado diferencias significativas en la eficacia clínica entre los diferentes principios activos, si bien se prefiere el uso de los nuevos antipsicóticos debido a su mejor perfil de efectos adversos al actuar de una manera más selectiva a nivel de los receptores D2 del área mesolímbica del cerebro60
Sin embargo, los fármacos antipsicóticos se reservan como segunda línea de tratamiento después de los alfa-2 adrenérgicos, debido a los potenciales efectos a largo plazo en la población pediátrica, así como a su peor perfil de seguridad.
Los principales efectos secundarios descritos en este grupo farmacológico son los efectos extrapiramidales, ganancia de peso, mareo, somnolencia, hiperprolactinemia y efectos cardiovasculares (riesgo de prolongación del intervalo QT) 60
Antipsicóticos típicos
Diferentes estudios han evaluado la eficacia y seguridad de haloperidol, pimozide y flufenazina en el tratamiento del síndrome de Tourette en la edad pediátrica. 60, 69, 78 Los estudios de Hollis 2016, Ganos 2016, Martino 2018 (clase I), aportan un nivel de recomendación A para el uso del Haloperidol y de Pimozide en el tratamiento de los tics mientras que Flufenazina presenta un grado de recomendación B. 60, 69, 78 Haloperidol es el neuroléptico que más tiempo lleva utilizándose en el tratamiento de los tics y el que cuenta con más ensayos clínicos en población pediátrica. En los RCT con placebo tanto haloperidol como pimozide han sido eficaces en la reducción global de los tics aunque con mayor impacto en la subescalas de tics motores y mostraron una mejoría en las escalas de discapacidad y de evaluación clínica general. En el estudio en el que se compara haloperidol con pimozide ambos han demostrado una eficacia similar, si bien haloperidol ha resultado ser discretamente más eficaz en el grado de reducción de los tics aunque con una mayor tasa de efectos adversos (somnolencia, mareo, efectos extrapiramidales a corto y largo plazo) y mayor tasa de abandono. Pimozide por otra parte presenta mayor incidencia de alargamiento del intervalo QT en comparación con otros antipsicóticos a dosis altas.56, 65, 74
La flufenazina ha demostrado una menor eficacia que haloperidol aunque con mejor tolerabilidad (nivel B), por lo que no debería ser uno de los primeros fármacos a tener en cuenta.69
Antipsicóticos de segunda generación
Los antipsicóticos de segunda generación son antagonistas selectivos de los receptores D2 en áreas mesolímbicas con cierta acción como antagonistas del receptor 5HT2 de la serotonina 60, 69
Dentro de este grupo se ha estudiado la eficacia de risperidona y aripiprazol (recomendación A) sulpirida, tiapride, ziprasidona y olanzapina (nivel B) y quetiapina (recomendación C) 60, 69
Risperidona es uno de los antipsicóticos atípicos más utilizados en la edad pediátrica. Presenta un efecto anti-5HT2 a dosis bajas y anti-D2 a dosis altas lo que puede inducir efectos secundarios similares al de los antipsicóticos clásicos a dosis elevadas. Ha demostrado ser eficaz a corto plazo en la reducción de los tics, con un tamaño de efecto medio-grande, además de disminuir el grado de discapacidad y mayor grado de mejoría global en los estudios frente a placebo (recomendación A). En los estudios comparativos, presenta una eficacia similar a pimozide con un discreto mayor efecto en reducción de los tics. En cuanto a efectos adversos, risperidona es uno de los fármacos de este grupo que con más frecuencia induce ganancia de peso e hiperprolactinemia y a dosis altas puede producir efectos extrapiramidales. 56, 65, 74
Aripiprazol también cuenta con múltiples estudios clase I en los últimos años que demuestran eficacia y seguridad en el tratamiento de los tics (recomendación A). 56, 65, 74 Actúa como agonista parcial D2, y como agonista parcial 5-HT1A y 5-HT2C.
A corto plazo ha demostrado mayor eficacia frente a placebo en la disminución global de los tics, y en las subescalas de tics motores y fónicos así como en la reducción de discapacidad y mejoría global. Así mismo, en estudios comparativos frente a risperidona (clase I) ha demostrado una eficacia similar, mientras que los estudios frente a haloperidol y tiapride no han resultado concluyentes. Entre sus efectos adversos se describen somnolencia, mareo, aumento de peso y nauseas aunque su perfil de seguridad es de los mejores junto con olanzapina. Es junto con risperidona, el fármaco de elección después de los alfa-2 adrenérgicos. 56, 65, 74
Tiaprida y sulpiride son ambos fármacos de la familia de las benzamidas, y actúan de una manera selectiva frente a receptores D2. Ambos han demostrado una reducción global de los tics aunque con un nivel de evidencia B, siendo mejores los resultados en la literatura para tiapride que para sulpiride. Sin embargo la frecuencia de efectos adversos que presentan, similar a la de otros antipsicóticos, hacen que no sean recomendados como primera opción de tratamiento. 56, 65, 74
Ziprasidona presenta un nivel de evidencia B para el tratamiento de los tics en la edad pediátrica56, 65 ya que cuenta únicamente con un estudio clase I controlado con placebo en edad pediátrica. En este estudio ha demostrado mayor reducción de tics frente a placebo a corto plazo. Entre sus efectos adversos se han descrito somnolencia, sedación, acatisia y alarga el intervalo QT más que otros antipsicóticos atípicos, sin embargo, no parece producir un significativo aumento de peso, por lo que podría resultar de utilidad en niños con sobrepeso.
Olanzapina ha demostrado en un estudio clase I frente a haloperidol en niños, así como en estudios abiertos y casos clínicos aislados, una eficacia similar a este en la reducción de los tics con menor tasa de efectos adversos.69 Sin embargo, se precisa de más estudios que avalen estos datos (recomendación B).
Metoclopramida es un antipsicótico atípico cuyo uso más extendido es como antiemético. Series de casos y un RCT frente a placebo clase I avalan su eficacia en la reducción de tics.60 Su elevada tasa de efectos extrapiramidales y el nivel de evidencia B, hacen que su uso en el tratamiento de los tics sea limitado60 78
Existen casos clínicos y estudios retrospectivos que reportan mejoría de los tics en niños que han sido tratados con quetiapina69 Actualmente la evidencia para recomendar este fármaco en pediatría es mínima (recomendación C).
5.3.3. Antiepilépticos
Algunos estudios han intentado demostrar el efecto de los fármacos antiepilépticos en el tratamiento del síndrome de Tourette en la edad pediátrica. Los únicos fármacos estudiados a este respecto han sido el topiramato, el levetiracetam y el ácido valproico.
Topiramato es un fármaco antiepiléptico que actúa bloqueando los canales de sodio y potencia la actividad del GABA. En un estudio clase I (RCT mixto de 29 pacientes) ha demostrado mejoría en la reducción de tics frente a placebo a bajas dosis60, siendo los efectos secundarios más frecuentes los problemas cognitivos y del lenguaje, somnolencia, pérdida de peso y puede aumentar el riesgo de litiasis renal. 56, 65, 74 Sin embargo en un metaanálisis que incluye 9 RCT de muy baja calidad, no se encontraron diferencias en la reducción de tics frente a placebo.79 Por lo tanto aunque topiramato puede ser eficaz, la evidencia actual para recomendar su uso en el tratamiento de los trastornos de tics es baja (recomendación B).
Se ha realizado 1 estudio RCT cruzado controlado con placebo para evaluar la eficacia de levetiracetam en el tratamiento del síndrome de Tourette.60 El estudio de calidad dudosa, ha demostrado que levetiracetam no ha resultado eficaz en el control de los tics, (recomendación B).
En cuanto al ácido valproico, una revisión sistemática y metaanálisis de estudios de baja calidad80 aportan datos de la no eficacia del fármaco en el tratamiento de los tics (recomendación U).
5.3.4. Depletores de dopamina
La tetrabenazina (TBZ) es un inhibidor del transportador vesicular de la dopamina VAMT2 indicado en el tratamiento del corea de Huntington, aunque posteriormente su uso se ha extendido al tratamiento de otros trastornos del movimiento hiperquinéticos como las mioclonias, las distonias y los tics81. Entre los efectos secundarios de TBZ se encuentran la somnolencia, náuseas, depresión, insomnio, acatisia, parkinsonismo, así como cuadros distónicos.
En la literatura encontramos dos ensayos abiertos y un estudio de cohortes retrospectivo realizado en un grupo reducido de pacientes en edad pediátrica con síndrome de Tourette69 que demuestran una reducción significativa de los tics con TBZ (estudios clase III y IV). Sin embargo, se precisa de mayor evidencia para poder recomendar este fármaco de manera sistemática (recomendación U).
Más recientemente se está investigando el papel de la deutetrabenazina en el tratamiento del síndrome de Tourette. Se trata de es un análogo de la TBZ al que se le ha añadido una molécula de deuterio (isotopo pesado de hidrógeno) de tal manera que prolonga la vida media del fármaco y reduce la variabilidad del metabolismo de la TBZ, con lo que se pretende reducir la dosis, la frecuencia de tomas y mejorar la tolerabilidad, suponiendo un mejor perfil de seguridad. En un ensayo abierto con deutetrabenazina realizado en 23 niños y adolescentes,81 se observa una mejoría significativa en la reducción de tics, sin embargo, no contamos con evidencia suficiente para recomendar su uso (recomendación U).
5.3.5 Inhibidores monoaminooxidasa B (IMAO B)
Selegilina es un inhibidor de la monoaminoxidasa B que actúa dentro de la vía metabólica de la dopamina. Existe un RCT de baja calidad realizado en población pediátrica con síndrome de Tourette que aporta resultados no concluyentes (recomendación U).60
5.3.6. Agonistas dopaminérgicos
Dentro de este grupo encontramos estudios en población pediátrica con síndrome de Tourette con Pergolide y Pramipexol, ambos fármacos agonistas dopaminérgicos utilizados en el tratamiento de la enfermedad de Parkinson. Dos RCT frente a placebo para pergolide, uno de ellos cruzado y otro para pramipexol, todos ellos de baja calidad, han ofrecido resultados no concluyentes por lo que no se recomienda su uso en el tratamiento del síndrome de Tourette en edad pediátrica (recomendación U). 60
5.3.7 Antagonistas GABA, relajantes musculares
Baclofeno es un fármaco relajante muscular que actúa a nivel de los receptores GABA utilizado en el tratamiento de la espasticidad en pediatría. Un RCT cruzado frente a placebo en un grupo de 10 pacientes pediátricos, ha demostrado efectividad en la reducción de tics con mejoría en las escalas de discapacidad y de afectación global60, sin embargo, el estudio es de baja calidad debido al reducido número de pacientes por lo que hay que tomar los resultados con cautela (recomendación U).
5.3.8. Inhibidores selectivos de la recaptación de serotonina (ISRS)
La eficacia de la fluoxetina en el tratamiento de los tics en población pediátrica se ha evaluado mediante un RCT frente a placebo y otro RCT cruzado en población mixta pediátrica y adulta60 En ambos estudios (clase I) fluoxetina no consiguió demostrar ser más eficaz en el control de los tics que placebo, (recomendación A) aunque cuando se administró como tratamiento del trastorno obsesivo compulsivo asociado al síndrome de Tourette, no se observó un empeoramiento de los tics. 60 61, por lo que se reserva su uso para esta indicación.
5.3.9 Toxina botulínica
Varios estudios han intentado demostrar la utilidad de la toxina botulínica en el tratamiento de los tics. 56, 65, 74 82 Su uso está extendido y resulta eficaz en el tratamiento de otros trastornos del movimiento pediátricos, como las distonías, por lo que se ha postulado que podría resultar eficaz en el control de los tics. Un RCT cruzado que incluía 18 niños y adultos, reportó disminución de la intensidad de los tics tras administración intramuscular de toxina botulínica, aunque no se pudo demostrar una disminución en la frecuencia de los tics.60 Más recientemente en una revisión de Cochrane, se describe 1 RCT mixto, en el que no se consigue demostrar mejoría sintomática frente a placebo.82 Los datos de los estudios publicados junto con el hecho de que se trata de un tratamiento invasivo no exento de efectos adversos (la toxina produce una denervación de la zona donde se infiltra dando lugar a debilidad e impotencia funcional transitoria de los músculos afectados) hacen que no se recomienden en el tratamiento del síndrome de Tourette (recomendación U).
5.3.10. Inmunoglobulinas intravenosas
En un estudio paralelo controlado con placebo realizado en población pediátrica y adulta con diagnóstico de síndrome de Tourette y TOC no se han encontrado diferencias en la reducción de la sintomatología tras la administración de inmunoglobulinas endovenosas.60 Se concluye por lo tanto que no existe suficiente evidencia para poder recomendar su uso (nivel U). Sí han demostrado ser eficaces en el tratamiento de los tics y otros trastornos del movimiento asociados a enfermedades autoinmunes con positividad de los anticuerpos antineuronales o en el caso de las encefalitis autoinmunes (recomendación A) Sin embargo, no ha demostrado ser una terapia eficaz en el tratamiento del trastorno de tics inducido por infección estreptocócica (PANDAS) al igual que los antibióticos.60
5.3.11. Otros tratamientos
También se han realizado estudios para evaluar la eficacia de otros fármacos en el tratamiento de los tics, como la mecamilamina83 (recomendación U) un antagonista del receptor nicotínico de acetilcolina, la nicotina transdérmica (recomendación A) 60 y la N-acetilcisteína (recomendación B).84 Ninguno de ellos ha demostrado ser más eficaz que placebo en el tratamiento de los tics en pediatría, por lo que no se puede recomendar su uso. Uno de los fármacos prometedores a este respecto es el ecopipam. Se trata de un antagonista selectivo de los receptores D₁ / D₅ de la dopamina, con poca afinidad por los receptores de la dopamina tipo D₂ o los receptores 5-HT₂. Se ha realizado un RCT en niños (40 sujetos) donde se describe mejoría importante en el control de tics y disminución del grado de discapacidad85, por lo que podría ser un fármaco de elección en el futuro (nivel B).
5.4. Psicoeducación
Las guías de práctica clínica existentes hasta la fecha recomiendan que todos los pacientes con síndrome de Tourette u otros trastornos de tics crónicos deben recibir psicoeducación.56, 65, 74 86 Es el primer paso en el tratamiento de estos trastornos y para muchos pacientes es la única intervención terapéutica que van a precisar, especialmente en los casos leves sin discapacidad asociada. 56, 65, 74
Es una medida fundamental mediante la cual se informa a la familia y a los pacientes acerca de todo lo referente a la fisiopatología, historia natural, evolución clínica de los tics (cambios en la frecuencia, intensidad y fenomenología de los tics, reconocimiento de situaciones que pueden predisponer o empeorar la sintomatología), pronóstico, terapias disponibles, indicaciones de tratamiento y objetivos terapéuticos. También se informa acerca de las comorbilidades que pueden aparecer asociadas al trastorno. 65, 74
El objetivo fundamental de la psicoeducación va encaminado a resolver las dudas que pueda haber acerca de la enfermedad mejorando el control de los síntomas y disminuyendo los niveles de ansiedad y el sentimiento de culpa en el paciente y la familia y como consecuencia mejorar la calidad de vida del niño.
Habitualmente se requiere de varias sesiones, de tal manera que pacientes y familiares comprendan e interioricen la información recibida y al mismo tiempo puedan resolver las dudas que vayan surgiendo, siendo necesario el abordaje multidisciplinar y la intervención en las diferentes áreas del paciente: nivel familiar, social y en el colegio. Si es preciso, se proporcionará información escrita al centro escolar u otros ámbitos relevantes para el paciente de tal manera que puedan aplicarse las adaptaciones metodológicas necesarias en cada caso para facilitar la mejor integración del niño.
Al menos dos estudios clase I realizados en población pediátrica han evaluado la eficacia de la psicoeducación en el tratamiento del Síndrome de Tourette, evidenciándose una menor eficacia en el control de los síntomas con psicoeducación sólo en comparación con otras terapias cognitivas (HRT/CBIT), (recomendación A), aunque ha resultado ser más eficaz que la aplicación de ninguna intervención.77, 87
Por lo tanto, en casos con afectación moderada e importante grado de discapacidad la psicoeducación suele resultar una terapia insuficiente y resulta necesaria la introducción de otras intervenciones terapéuticas como las terapias cognitivas o el tratamiento farmacológico.
5.5. Terapias cognitivas
Hasta la fecha, se han ensayado diferentes terapias cognitivas en el tratamiento del síndrome de Tourette y cada vez más se intenta evaluar la eficacia de las mismas. En las guías de manejo del síndrome de Tourette recomiendan el entrenamiento en reversión de hábitos y la intervención global de comportamiento para tics (HRT/CBIT) como primera opción terapéutica por delante de la terapia farmacológica debido a la seguridad y eficacia demostrada de estas terapias en población pediátrica56, 65, 74. Existen, por otra parte, estudios que evalúan la eficacia de otras terapias cognitivas como la psicoterapia, la exposición in- vivo con prevención de respuesta, la practica negativa masificada, las técnicas de relajación, entrenamiento de control de ira, entrenamiento parental y el biofeedback. El objetivo de todas ellas es la mejoría de los síntomas asociados al síndrome de Tourette y se precisa de varias sesiones de tratamiento impartidas por un psicólogo entrenado y especializado en la aplicación de las mismas.
5.5.1. Entrenamiento en Reversión de Hábitos y la Intervención Global de Comportamiento para Tics (HRT/CBIT)
El HRT se basa en la teoría de que los tics son la respuesta inducida por una estímulo externo (situación, lugar) o interno como una sensación premonitoria (somática/interoceptiva) que lleva a la realización y repetición de un movimiento o serie de movimientos o sonidos y postula. Si asociamos otra respuesta que compita con el tic y que sea más aceptable y menos disruptiva, ésta hará que se inhiba el tic, 65, 74 Para ello y durante las diferentes sesiones, los terapeutas entrenan al paciente para que sea capaz de reconocer las implicaciones que tiene el tic en su vida, en que situaciones aparece, saber reconocer la sensación premonitoria previa a la aparición del tic así como la cadena de acontecimientos que lo desencadenan y entrenar al paciente en la generación de una respuesta que compita con el hábito (tic) y que no sea perjudicial para él. Además se entrena la generalización de la técnica mediante la cual el paciente imagina la utilización de la respuesta incompatible con el tic en las diversas situaciones donde el hábito ocurre de manera que consiga inhibirlo con éxito. El CBIT incluye el HRT como su pilar fundamental pero además ofrece un entrenamiento en terapias de relajación así como en la identificación de las situaciones que promueven o empeoran los tics en el paciente. Además en el CBIT, la respuesta que compite con el tic no tiene que implicar necesariamente la contracción de otro grupo muscular, y puede sustituirse por otras acciones que inhiban el hábito.
En los estudios publicados (al menos dos estudios clase I) el HRT y el CBIT resultan tan efectivos como la medicación en el tratamiento del síndrome de Tourette pediátrico, pero con menos efectos secundarios por lo que deben ser empleados de primera línea (recomendación A) 56, 86 77, 87 HRT y CBIT han demostrado su eficacia no sólo en la reducción de los tics y en el grado de discapacidad en las escalas a corto plazo, sino que además han demostrado mantener su eficacia tras 12 meses del tratamiento86
En el RCT (estudio Clase I) que compara CBIT con psicoeduación se observa una mayor reducción de tics y mejoría de la discapacidad con CBIT, pero esta respuesta resulta menor en el subgrupo de pacientes que además están recibiendo terapia farmacológica87, quizás por la mayor gravedad de este subgrupo de pacientes. En cuanto al número de sesiones necesarias, los estudios muestran que de 5 a 10 sesiones resultan efectivas ya sean por vídeo conferencia o presenciales (estudio Clase I no muestra diferencias).60 Uno de los inconvenientes de estas terapias es que no influyen sobre las comorbilidades y que además, puede resultar complicado encontrar terapeutas entrenados en estas terapias.
5.5.2 Exposición in- vivo con prevención de respuesta (ERP)
Esta terapia pretende que los pacientes con trastorno de tics se habitúen a la sensación de urgencia premonitoria que precede y desencadena el tic de tal manera que poco a poco el paciente se acostumbre a esa sensación y sea capaz de evitar y reprimir la aparición del tic. 60. En un estudio clase I que compara HRT y ERP en un grupo de 25 niños, no se consiguen resultados concluyentes no pudiendo demostrar diferencias entre ambas terapias.60
5.5.3 Práctica negativa masificada
En esta terapia se instruye al paciente para que repita de forma continua durante un periodo de tiempo estipulado los tics descansando posteriormente y repitiendo las mismas instrucciones posteriormente. La exposición repetida se asociaría a una disminución en el impulso de realización del tic y finalmente se conseguiría la deshabituación de los mismos. En un estudio de baja calidad que incluye 22 pacientes pediátricos y adultos, en el que se compara HRT frente a práctica negativa masificada, no se obtienen resultados concluyentes (recomendación U),60 si bien HRT parece más eficaz en la reducción global de los tics.
5.5.4. Otros tratamientos
Otras terapias cognitivas estudiadas como las técnicas de relajación, el entrenamiento parental60 y el bio-feedback88 no han demostrado efectividad en el tratamiento de los tics en niños con síndrome de Tourette. El entrenamiento de control de ira por su parte, ha demostrado ser más eficaz (recomendación B) que la psicoterapia convencional especialmente en el tratamiento de niños que asocian conductas disruptivas60 aunque no ha demostrado una mejoría significativa en la reducción de los tics.
5.6. Terapias físicas
En este subgrupo se incluyen la estimulación cerebral profunda (DBS) y la estimulación magnética transcraneal (TMS).
5.6.1. Estimulación cerebral profunda (DBS)
En los últimos años se ha intentado evaluar la utilidad de la DBS en el tratamiento del síndrome de Tourette grave, fundamentalmente en población adulta. Esta intervención consiste fundamentalmente en la colocación de unos electrodos en ganglios basales, siendo la diana terapéutica variable en función de la patología a tratar, que envían estímulos de una determinada frecuencia, intensidad y dirección en el sistema nervioso central. Estos electrodos están conectados por un cable a un programador subcutáneo que permite modificar los parámetros externamente. Su uso en el tratamiento del síndrome de Tourette es controvertido y actualmente no existe ninguna evidencia científica que apoye su uso en pediatría (recomendación U). Existen algunos estudios realizados en población adulta que incluyen algún paciente menor de 18 años.89, 90 En un estudio Clase I realizado en 16 pacientes no hay mejoría significativa a los 3 meses de tratamiento (recomendación B) comparando con placebo.89 Otros estudios, como el estudio abierto de Martinez-Ramirez clase IV, muestra una discreta mejoría en las escalas que valoran los tics (recomendación U), sin embargo existe riesgo de efectos secundarios graves como consecuencia de la cirugía90.
5.6.2. Estimulación magnética transcraneal
Su uso en el tratamiento de los tics es objeto de diferentes estudios, casi todos ellos realizados en población adulta60 78. En un RCT (estudio clase I) que incluye pacientes pediátricos91 no se ha demostrado que existan diferencias en el control de los tics frente a placebo (nivel B). Por lo tanto, la TMS no se recomienda. (recomendación U).
5.7. Terapias alternativas o complementarias
La dificultad que conlleva en muchas ocasiones el correcto control de los tics y otros síntomas asociados al síndrome de Tourette a pesar de las terapias disponibles ha llevado a que se hayan ensayado múltiples terapias dentro de las conocidas como terapias alternativas o complementarias. Entre ellas encontramos estudios que evalúan la eficacia de los ácidos grasos Omega 3, los gránulos de Ningdon y 5-Ling, la acupuntura y las hierbas chinas, la hipnosis, la musicoterapia y los programas de actividad física entre otras.
5.7.1 Ácidos grasos Omega 3
En la literatura encontramos un RCT realizado en población pediátrica en el que se comparaba el efecto de los ácidos grasos omega 3 frente a placebo en pacientes con síndrome de Tourette.60 El estudio, de baja calidad, no mostró resultados concluyentes a favor del uso de los ácidos grasos omega 3 (recomendación U). Sin embargo podrían tener un papel en los trastornos relacionados y en el bienestar del paciente presentando un buen perfil de efectos secundarios60 92
5.7.2 Acupuntura y hierbas chinas
Según el metaanálisis de Hollis la acupuntura podría ser efectiva en base a un RCT publicado por Chi con 60 niños en los que se compara acupuntura y hierbas chinas frente haloperidol+ trihexifenidilo60 sin embargo el estudio resulta de baja calidad, por lo que habría que tomar con precaución estas conclusiones (recomendación U). En cambio, una revisión sistemática que incluye 7 RCT realizados en China, todos ellos de baja calidad en los que se valora la eficacia de la acupuntura y las hierbas chinas en el tratamiento del trastorno de tics, no demuestra mejoría de los tics frente a placebo (recomendación U)93. Aunque en general es una terapia bien tolerada, presenta efectos adversos derivados de la punción (infecciones, neumotórax, lesión nerviosa...) 92 y dada la falta de evidencia clara, no podemos recomendar su uso en pediatría. Por otra parte, los gránulos 5-Ling han sido evaluados en un estudio Clase I frente a placebo y tiapride y han demostrado una eficacia mayor que placebo y similar a tiapride en el control de los tics, aunque con menos efectos secundarios (recomendación B)94. Estos tratamientos sólo están disponibles en China, y además no conocemos las interacciones farmacológicas que puedan producirse con otros fármacos utilizados en el tratamiento de los tics.
5.7.3. Otras terapias
Se han encontrado publicaciones que evalúan la eficacia de la hipnosis, la musicoterapia y los programas de ejercicio físico en la reducción de los tics y otros síntomas en niños con síndrome de Tourette. La revisión sistemática de Kim, que incluye 8 trabajos (reporte de casos, estudios observacionales, Clase IV) que evalúa la eficacia del ejercicio físico en el control de los tics indica que si bien parece que el ejercicio suave podría conducir a cierta mejora sintomática, el ejercicio vigoroso empeoraría los tics.95 Dicho estudio no nos permite obtener conclusiones claras acerca de la eficacia de este tratamiento en la reducción de los tics, (recomendación U), aunque la práctica de ejercicio regular aporta beneficios en la salud global del paciente y puede reducir el nivel de estrés.
En cuanto a la hipnosis, la revisión sistemática Kumar que incluye un estudio retrospectivo y casos aislados (Clase IV) no demuestran una clara eficacia terapéutica en la reducción de los tics. (recomendación U) 92.
Otros estudios tampoco han demostrado que escuchar música o tocar un instrumento mejore de una manera objetiva los síntomas del síndrome de Tourette, aunque estas prácticas, lejos de tener efectos secundarios, pueden mejorar los niveles de estrés y ansiedad y mejorar la calidad de vida del paciente92.
5.8 Tratamiento de las comorbilidades
El tratamiento del trastorno por déficit de atención e hiperactividad, así como el trastorno obsesivo-compulsivo en pacientes con síndrome de Tourette está descrito en el apartado de comorbilidades psiquiátricas.
5.9. Conclusiones
La psicoeducación debe constituir el primer paso en el tratamiento en todos los casos de síndrome de Tourette en la edad pediátrica, sin embargo, la decisión de ofrecer intervenciones conductuales más específicas o medicación se determinará por diversos factores, como la gravedad y el deterioro asociado a los tics tanto a nivel físico (lesiones, contracturas), como emocional (ansiedad, depresión, baja autoestima), social (relaciones sociales y familiares) y escolar (falta de concentración, “bullying”, fracaso escolar). También se tendrá en cuenta la disponibilidad de las terapias cognitivas que han demostrado ser más eficaces, como la HRT, CBIT, ERP (recomendación A) así como las preferencias de tratamiento de los niños y sus familias. Si hay comorbilidades, el impacto relativo de éstas en el funcionamiento del niño determinará a qué condición se le da prioridad en el tratamiento. En la elección del fármaco, no sólo se tendrá en cuenta la evidencia existente (recomendación A: alfa2 adrenérgicos y antipsicóticos para tics, alfa dos adrenérgicos para TDAH y ISRS para TOC) sino también el perfil de efectos adversos de cada fármaco y las potenciales interacciones farmacológicas.
Algoritmo terapéutico síndrome de Tourette. en la edad pediátrica.
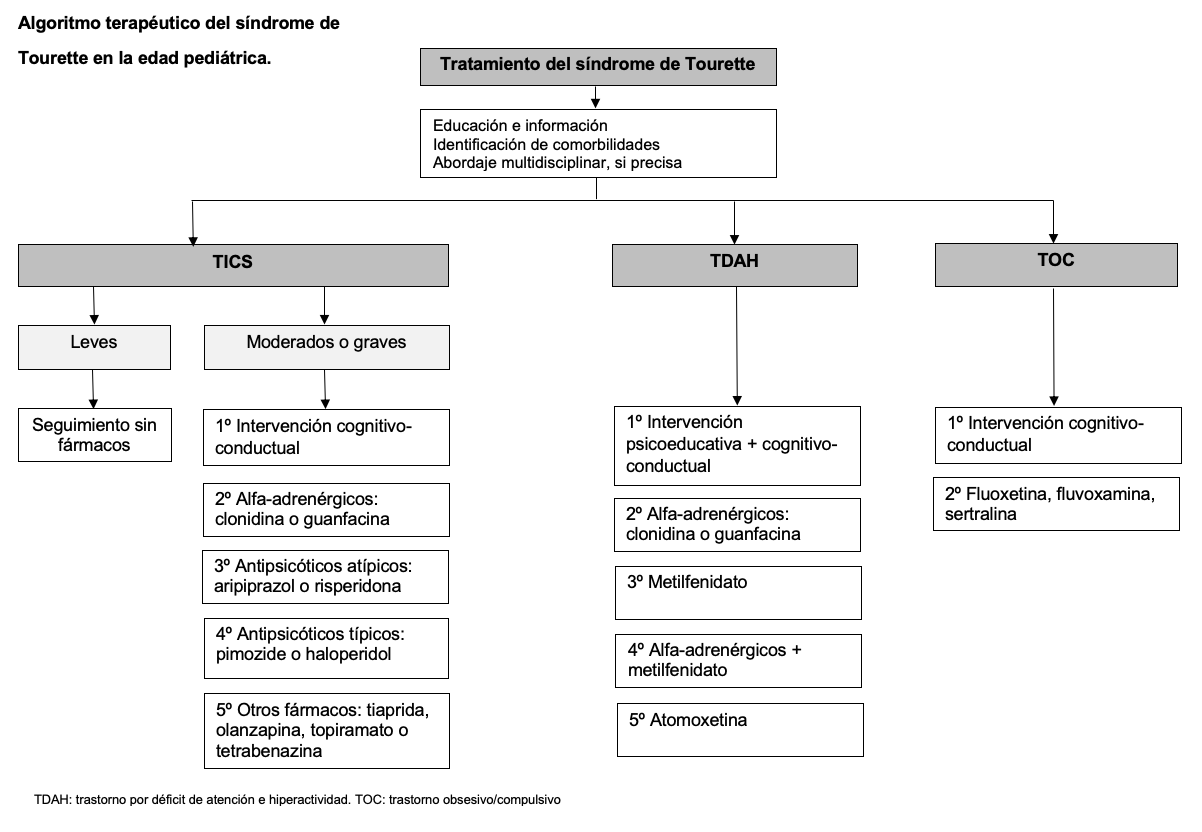
| Tabla. Principales fármacos manejo Síndrome de Tourette y sus comorbilidades |
|---|
|
Fármaco
|
posología y forma de administración, Dosis inicial
|
dosis habituales de mantenimiento
|
grado de evidencia
|
|
agonistas alfa - adrenérgicos
|
|
Clonidina1,2
|
0.025 – 0.05 mg/día. v.o. Qd al acostarse.
|
0.2 – 0.3 mg/día. Tid/Qid.
|
A
|
|
Guanfacina1 comprimidos liberación inmediata
|
< 45 kg: 0.5 mg/día. > 45 kg: 1 mg/día. v.o. Qd por la noche.
|
Rango: 0.05 – 0.12 mg/kg/día.
25 – 42 kg: max. 4 mg/día.
42 – 49.5 kg: max. 5 mg/día.
49.5 – 58.5: max. 6 mg/día.
> 58.5: max. 7 mg/día. Qd/Bid.
|
A
|
|
Guanfacina1 comprimidos de liberación retardada
|
1 mg/día. v.o. Qd por la mañana o tarde.
|
1 – 4 mg/día (max. 4 mg/día). Qd.
|
A
|
|
antipsicóticos
|
|
aripiprazol1
|
2 mg/día. v.o. Qd.
|
5 – 20 mg/día. Qd.
|
A
|
|
Risperidona1
|
< 50 kg: 0.25 mg/día. > 50 kg: 0.5 mg/día. v.o. Qd.
|
< 50 kg: 0.5 (0.25 – 0.75) mg/día. > 50 kg: 1 (0.5 – 1.5) mg/día. Bid.
|
A
|
|
pimozida1,3
|
0.5 – 1 mg/día (0.05 mg/kg/día). v.o. Qd vespertina.
|
2 – 4 mg/día (max. 0.2 mg/kg/día, no sobrepasar 10 mg/día). Bid/Tid.
|
A
|
|
Haloperidol
|
0.25 – 0.5 mg/día. v.o. Qd vespertina.
|
3 – 13 años: 0.5 – 3 mg/día. > 13 años: 0.75 – 5 mg/día (max. 6 – 10 mg/día). Bid/Tid.
|
A
|
|
otros fármacos
|
|
topiramato1
|
15 – 25 mg/día. v.o. Qd.
|
50 – 100 mg/día. Bid/Tid.
|
B
|
|
tratamiento de las comorbilidades
|
|
Metilfenidato comprimidos de liberación inmediata
|
0.3 mg/kg/dosis. v.o.
|
0,3 – 1 mg/kg/día (20-30 mg/día, max. 60 mg/día). Bid/Tid.
|
A
|
|
metilfenidato cápsulas de liberación modificada (esferas/pellets)
|
10 mg/día v.o. Qd.
|
En función de la respuesta clínica y de la presencia de efectos secundarios. Max: 60 mg/día. Qd.
|
A
|
|
Metilfenidato Comprimidos recubiertos de liberación modificada con tecnología osmótica (OROS)
|
18 mg/día. v.o. Qd.
|
En función de la respuesta clínica y de la presencia de efectos secundarios. Max: 54 mg/día. Qd.
|
A
|
|
Atomoxetina
|
< 70 kg: 0.5 mg/kg/día.
> 70 kg: 40 mg. v.o. Qd por la mañana.
|
< 70 kg: 1,2 mg/kg/día.
> 70 kg: 80 mg/día (max: 100 mg/día). Qd/Bid.
|
B
|
|
fluoxetina4
|
< 7 años: desde el inicio la misma dosis que mantenimiento, 5 mg/día o 0.25 mg/Kg/día.
≥ 7 años:
10 mg/día.
v.o. Qd
|
< 7 años: 5 mg/día o 0.25 mg/Kg/día.
≥ 7 años:
Bajo peso:
10 mg/día.
Alto peso y adolescentes:
20 mg/día (max. 60 mg/día). Qd
|
B
|
1Indicación fuera de ficha técnica en España (uso off-label).
2No se recomienda combinar con metilfenidato (especificado en ficha técnica).
3La FDA recomienda la determinación del genotipo del citocromo CYP2D6 para dosis superiores a 0.05 mg/Kg/día. En metabolizadores lentos, la dosis máxima debe ser 0.05 mg/kg/día.
4Indicación para el TOC fuera de ficha técnica en España (uso off-label)
BIBLIOGRAFIA
- Pauls DL, Fernandez TV, Mathews CA, State MW, Scharf JM. The Inheritance of Tourette Disorder: A review. Journal of obsessive-compulsive and related disorders 2014;3(4):380-385.
- Dale RC. Tics and Tourette: a clinical, pathophysiological and etiological review. Current opinion in pediatrics 2017;29(6):665-673.
- Blackburn JS. Tic Disorders and PANDAS. Seminars in pediatric neurology 2018;25:25-33.
- Ercan-Sencicek AG, Stillman AA, Ghosh AK, et al. L-histidine decarboxylase and Tourette's syndrome. The New England journal of medicine 2010;362(20):1901-1908.
- Karagiannidis I, Dehning S, Sandor P, et al. Support of the histaminergic hypothesis in Tourette syndrome: association of the histamine decarboxylase gene in a large sample of families. Journal of medical genetics 2013;50(11):760-764.
- Abelson JF, Kwan KY, O'Roak BJ, et al. Sequence variants in SLITRK1 are associated with Tourette's syndrome. Science 2005;310(5746):317-320.
- Scharf JM, Yu D, Mathews CA, et al. Genome-wide association study of Tourette's syndrome. Molecular psychiatry 2013;18(6):721-728.
- Paschou P, Yu D, Gerber G, et al. Genetic association signal near NTN4 in Tourette syndrome. Annals of neurology 2014;76(2):310-315.
- Robertson MM, Eapen V, Singer HS, et al. Gilles de la Tourette syndrome. Nature reviews Disease primers 2017;3:16097.
- Willsey AJ, Fernandez TV, Yu D, et al. De Novo Coding Variants Are Strongly Associated with Tourette Disorder. Neuron 2017;94(3):486-499 e489.
- Brainstorm C, Anttila V, Bulik-Sullivan B, et al. Analysis of shared heritability in common disorders of the brain. Science 2018;360(6395).
- Abdulkadir M, Tischfield JA, King RA, et al. Pre- and perinatal complications in relation to Tourette syndrome and co-occurring obsessive-compulsive disorder and attention-deficit/hyperactivity disorder. Journal of psychiatric research 2016;82:126-135.
- Neuner I, Schneider F, Shah NJ. Functional neuroanatomy of tics. International review of neurobiology 2013;112:35-71.
- Greene DJ, Williams Iii AC, Koller JM, Schlaggar BL, Black KJ. Brain structure in pediatric Tourette syndrome. Molecular psychiatry 2017;22(7):972-980.
- Worbe Y, Lehericy S, Hartmann A. Neuroimaging of tic genesis: Present status and future perspectives. Movement disorders : official journal of the Movement Disorder Society 2015;30(9):1179-1183.
- Greene DJ, Schlaggar BL, Black KJ. Neuroimaging in Tourette Syndrome: Research Highlights From 2014-2015. Current developmental disorders reports 2015;2(4):300-308.
- Walkup JT, Ferrao Y, Leckman JF, Stein DJ, Singer H. Tic disorders: some key issues for DSM-V. Depression and anxiety 2010;27(6):600-610.
- McNaught KS, Mink JW. Advances in understanding and treatment of Tourette syndrome. Nature reviews Neurology 2011;7(12):667-676.
- Scahill L, Sukhodolsky DG, Williams SK, Leckman JF. Public health significance of tic disorders in children and adolescents. Advances in neurology 2005;96:240-248.
- Caurin B, Serrano M, Fernandez-Alvarez E, Campistol J, Perez-Duenas B. Environmental circumstances influencing tic expression in children. European journal of paediatric neurology : EJPN : official journal of the European Paediatric Neurology Society 2014;18(2):157-162.
- Bestha DP, Jeevarakshagan S, Madaan V. Management of tics and Tourette's disorder: an update. Expert opinion on pharmacotherapy 2010;11(11):1813-1822.
- Singer HS, Minzer K. Neurobiology of Tourette's syndrome: concepts of neuroanatomic localization and neurochemical abnormalities. Brain & development 2003;25 Suppl 1:S70-84.
- Leonard HL, Swedo SE. Paediatric autoimmune neuropsychiatric disorders associated with streptococcal infection (PANDAS). The international journal of neuropsychopharmacology 2001;4(2):191-198.
- Martino D, Defazio G, Giovannoni G. The PANDAS subgroup of tic disorders and childhood-onset obsessive-compulsive disorder. Journal of psychosomatic research 2009;67(6):547-557.
- Singer HS JJ, Mink JW, Gilbert DD. Tics and Tourette Syndrome Movement disorders in childhood. 1st Edition ed: Elsevier Health Sciences, 2007:40-55.
- Fernandez-Alvarez E, Aicardi, J. Tics and Tourette syndrome. Movement Disorders in children. 1st Edition ed: Mac Keith Press., 2001.
- Lehman LL, Gilbert DL, Leach JL, Wu SW, Standridge SM. Vertebral artery dissection leading to stroke caused by violent neck tics of Tourette syndrome. Neurology 2011;77(18):1706-1708.
- van Meerbeeck P, Behar C, Czernecki V, Roze E, Deniau E, Hartmann A. Motor tic of the neck: a probable cause of stroke in a child with Gilles de la Tourette syndrome. Movement disorders : official journal of the Movement Disorder Society 2011;26(5):928-929.
- Isaacs JD, Adams M, Lees AJ. Noncompressive myelopathy associated with violent axial tics of tourette syndrome. Neurology 2010;74(8):697-698.
- Eapen V, Fox-Hiley P, Banerjee S, Robertson M. Clinical features and associated psychopathology in a Tourette syndrome cohort. Acta neurologica Scandinavica 2004;109(4):255-260.
- Robertson MM, Banerjee S, Eapen V, Fox-Hiley P. Obsessive compulsive behaviour and depressive symptoms in young people with Tourette syndrome. A controlled study. European child & adolescent psychiatry 2002;11(6):261-265.
- Conelea CA, Woods DW. The influence of contextual factors on tic expression in Tourette's syndrome: a review. Journal of psychosomatic research 2008;65(5):487-496.
- Leckman JF, Bloch MH, Scahill L, King RA. Tourette syndrome: the self under siege. Journal of child neurology 2006;21(8):642-649.
- Weiss MD, Baer S, Allan BA, Saran K, Schibuk H. The screens culture: impact on ADHD. Attention deficit and hyperactivity disorders 2011;3(4):327-334.
- Swing EL, Gentile DA, Anderson CA, Walsh DA. Television and video game exposure and the development of attention problems. Pediatrics 2010;126(2):214-221.
- Sanger TD. TIC DISORDERS AND TOURETTE SYNDROME IN CHILDREN. CONTINUUM: Lifelong Learning in Neurology 2007;13(1):139-153.
- Martino D, Mink JW. Tic disorders. Continuum 2013;19(5 Movement Disorders):1287-1311.
- Ong MT, Mordekar SR, Seal A. Fifteen minute consultation: tics and Tourette syndrome. Archives of disease in childhood Education and practice edition 2016;101(2):87-94.
- Sanger TD, Chen D, Fehlings DL, et al. Definition and classification of hyperkinetic movements in childhood. Movement disorders : official journal of the Movement Disorder Society 2010;25(11):1538-1549.
- Jones KS, Ramphul K. Tourette Syndrome And Other Tic Disorders. StatPearls. Treasure Island (FL)2018.
- Soman T, Lang AE. MOVEMENT DISORDERS. CONTINUUM: Lifelong Learning in Neurology 2009;15(6):167-190.
- Shprecher D, Kurlan R. The management of tics. Movement disorders : official journal of the Movement Disorder Society 2009;24(1):15-24.
- Rapanelli M, Frick LR, Pittenger C. The Role of Interneurons in Autism and Tourette Syndrome. Trends in neurosciences 2017;40(7):397-407.
- Bell L, Wittkowski A, Hare DJ. Movement Disorders and Syndromic Autism: A Systematic Review. Journal of autism and developmental disorders 2018.
- Canitano R, Vivanti G. Tics and Tourette syndrome in autism spectrum disorders. Autism : the international journal of research and practice 2007;11(1):19-28.
- Burd L, Li Q, Kerbeshian J, Klug MG, Freeman RD. Tourette syndrome and comorbid pervasive developmental disorders. Journal of child neurology 2009;24(2):170-175.
- Darrow SM, Grados M, Sandor P, et al. Autism Spectrum Symptoms in a Tourette's Disorder Sample. Journal of the American Academy of Child and Adolescent Psychiatry 2017;56(7):610-617 e611.
- Pringsheim T, Hammer T. Social behavior and comorbidity in children with tics. Pediatric neurology 2013;49(6):406-410.
- El Malhany N, Gulisano M, Rizzo R, Curatolo P. Tourette syndrome and comorbid ADHD: causes and consequences. European journal of pediatrics 2015;174(3):279-288.
- Robertson MM. A personal 35 year perspective on Gilles de la Tourette syndrome: assessment, investigations, and management. The lancet Psychiatry 2015;2(1):88-104.
- National Collaborating Centre for Mental H. National Institute for Health and Care Excellence: Clinical Guidelines. Attention Deficit Hyperactivity Disorder: Diagnosis and Management of ADHD in Children, Young People and Adults. Leicester (UK): British Psychological Society
Copyright (c) National Institute for Health and Care Excellence 2018., 2018.
- Freeman RD, Tourette Syndrome International Database C. Tic disorders and ADHD: answers from a world-wide clinical dataset on Tourette syndrome. European child & adolescent psychiatry 2007;16 Suppl 1:15-23.
- Rizzo R, Gulisano M, Cali PV, Curatolo P. Tourette Syndrome and comorbid ADHD: current pharmacological treatment options. European journal of paediatric neurology : EJPN : official journal of the European Paediatric Neurology Society 2013;17(5):421-428.
- Grupo de trabajo de la Guía de Práctica Clínica sobre el Trastorno por Défi cit de Atención con Hiperactividad (TDAH) en Niños y Adolescentes. Fundació Sant Joan de Déu, coordinador. Guías de Práctica Clínica en el SNS. Trastorno por Défi cit de Atención con Hiperactividad (TDAH) en Niños y Adolescentes: Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad, Política Social e Igualdad. Agència d´Informació, Avaluació i Qualitat (AIAQS) de Cataluña, 2010.
- Hirschtritt ME, Lee PC, Pauls DL, et al. Lifetime prevalence, age of risk, and genetic relationships of comorbid psychiatric disorders in Tourette syndrome. JAMA psychiatry 2015;72(4):325-333.
- Roessner V, Becker A, Banaschewski T, Freeman RD, Rothenberger A, Tourette Syndrome International Database C. Developmental psychopathology of children and adolescents with Tourette syndrome--impact of ADHD. European child & adolescent psychiatry 2007;16 Suppl 1:24-35.
- Rizzo R, Gulisano M, Martino D, Robertson MM. Gilles de la Tourette Syndrome, Depression, Depressive Illness, and Correlates in a Child and Adolescent Population. Journal of child and adolescent psychopharmacology 2017;27(3):243-249.
- Erbilgin Gun S, Kilincaslan A. Quality of Life Among Children and Adolescents With Tourette Disorder and Comorbid ADHD: A Clinical Controlled Study. Journal of attention disorders 2018:1087054718772158.
- de la Pena FR, Villavicencio LR, Palacio JD, et al. Validity and reliability of the kiddie schedule for affective disorders and schizophrenia present and lifetime version DSM-5 (K-SADS-PL-5) Spanish version. BMC psychiatry 2018;18(1):193.
- Hollis C, Pennant M, Cuenca J, et al. Clinical effectiveness and patient perspectives of different treatment strategies for tics in children and adolescents with Tourette syndrome: a systematic review and qualitative analysis. Health technology assessment 2016;20(4):1-450, vii-viii.
- Walsh KH, Soe K, Sarawgi S. Psychiatric Treatment and Management of Psychiatric Comorbidities of Movement Disorders. Seminars in pediatric neurology 2018;25:123-135.
- Abramovitch A, Dar R, Mittelman A, Wilhelm S. Comorbidity Between Attention Deficit/Hyperactivity Disorder and Obsessive-Compulsive Disorder Across the Lifespan: A Systematic and Critical Review. Harvard review of psychiatry 2015;23(4):245-262.
- Morand-Beaulieu S, Leclerc JB, Valois P, Lavoie ME, O'Connor KP, Gauthier B. A Review of the Neuropsychological Dimensions of Tourette Syndrome. Brain sciences 2017;7(8).
- Perez-Vigil A, Fernandez de la Cruz L, Brander G, et al. Association of Tourette Syndrome and Chronic Tic Disorders With Objective Indicators of Educational Attainment: A Population-Based Sibling Comparison Study. JAMA neurology 2018;75(9):1098-1105.
- Wei MH. The social adjustment, academic performance, and creativity of Taiwanese children with Tourette's syndrome. Psychological reports 2011;108(3):791-798.
- Cavanna AE, Servo S, Monaco F, Robertson MM. The behavioral spectrum of Gilles de la Tourette syndrome. The Journal of neuropsychiatry and clinical neurosciences 2009;21(1):13-23.
- Geller D, Biederman J, Faraone SV, et al. Clinical correlates of obsessive compulsive disorder in children and adolescents referred to specialized and non-specialized clinical settings. Depression and anxiety 2000;11(4):163-168.
- Scahill L, Riddle MA, McSwiggin-Hardin M, et al. Children's Yale-Brown Obsessive Compulsive Scale: reliability and validity. Journal of the American Academy of Child and Adolescent Psychiatry 1997;36(6):844-852.
- Ganos C, Martino D, Pringsheim T. Tics in the Pediatric Population: Pragmatic Management. Movement disorders clinical practice 2017;4(2):160-172.
- Kurlan R, Como PG, Miller B, et al. The behavioral spectrum of tic disorders: a community-based study. Neurology 2002;59(3):414-420.
- Coffey BJ, Biederman J, Smoller JW, et al. Anxiety disorders and tic severity in juveniles with Tourette's disorder. Journal of the American Academy of Child and Adolescent Psychiatry 2000;39(5):562-568.
- Marwitz L, Pringsheim T. Clinical Utility of Screening for Anxiety and Depression in Children with Tourette Syndrome. Journal of the Canadian Academy of Child and Adolescent Psychiatry = Journal de l'Academie canadienne de psychiatrie de l'enfant et de l'adolescent 2018;27(1):15-21.
- Gaze C, Kepley HO, Walkup JT. Co-occurring psychiatric disorders in children and adolescents with Tourette syndrome. Journal of child neurology 2006;21(8):657-664.
- Budman CL, Bruun RD, Park KS, Lesser M, Olson M. Explosive outbursts in children with Tourette's disorder. Journal of the American Academy of Child and Adolescent Psychiatry 2000;39(10):1270-1276.
- Elstner K, Selai CE, Trimble MR, Robertson MM. Quality of Life (QOL) of patients with Gilles de la Tourette's syndrome. Acta psychiatrica Scandinavica 2001;103(1):52-59.
- Eapen V, Cavanna AE, Robertson MM. Comorbidities, Social Impact, and Quality of Life in Tourette Syndrome. Frontiers in psychiatry 2016;7:97.
- Rizzo R, Pellico A, Silvestri PR, Chiarotti F, Cardona F. A Randomized Controlled Trial Comparing Behavioral, Educational, and Pharmacological Treatments in Youths With Chronic Tic Disorder or Tourette Syndrome. Frontiers in psychiatry 2018;9:100.
- Martino D, Pringsheim TM. Tourette syndrome and other chronic tic disorders: an update on clinical management. Expert review of neurotherapeutics 2018;18(2):125-137.
- Yang CS, Zhang LL, Zeng LN, Huang L, Liu YT. Topiramate for Tourette's syndrome in children: a meta-analysis. Pediatric neurology 2013;49(5):344-350.
- Yang CS, Zhang LL, Lin YZ, Guo Q. Sodium valproate for the treatment of Tourettes syndrome in children: a systematic review and meta-analysis. Psychiatry research 2015;226(2-3):411-417.
- Jankovic J, Jimenez-Shahed J, Budman C, et al. Deutetrabenazine in Tics Associated with Tourette Syndrome. Tremor and other hyperkinetic movements 2016;6:422.
- Pandey S, Srivanitchapoom P, Kirubakaran R, Berman BD. Botulinum toxin for motor and phonic tics in Tourette's syndrome. The Cochrane database of systematic reviews 2018;1:CD012285.
- Egolf A, Coffey BJ. Current pharmacotherapeutic approaches for the treatment of Tourette syndrome. Drugs of today 2014;50(2):159-179.
- Bloch MH, Panza KE, Yaffa A, et al. N-Acetylcysteine in the Treatment of Pediatric Tourette Syndrome: Randomized, Double-Blind, Placebo-Controlled Add-On Trial. Journal of child and adolescent psychopharmacology 2016;26(4):327-334.
- Gilbert DL, Murphy TK, Jankovic J, et al. Ecopipam, a D1 receptor antagonist, for treatment of tourette syndrome in children: A randomized, placebo-controlled crossover study. Movement disorders : official journal of the Movement Disorder Society 2018;33(8):1272-1280.
- Dabrowski J, King J, Edwards K, et al. The Long-Term Effects of Group-Based Psychological Interventions for Children With Tourette Syndrome: A Randomized Controlled Trial. Behavior therapy 2018;49(3):331-343.
- Sukhodolsky DG, Woods DW, Piacentini J, et al. Moderators and predictors of response to behavior therapy for tics in Tourette syndrome. Neurology 2017;88(11):1029-1036.
- Nagai Y, Cavanna AE, Critchley HD, Stern JJ, Robertson MM, Joyce EM. Biofeedback treatment for Tourette syndrome: a preliminary randomized controlled trial. Cognitive and behavioral neurology : official journal of the Society for Behavioral and Cognitive Neurology 2014;27(1):17-24.
- Welter ML, Houeto JL, Thobois S, et al. Anterior pallidal deep brain stimulation for Tourette's syndrome: a randomised, double-blind, controlled trial. The Lancet Neurology 2017;16(8):610-619.
- Martinez-Ramirez D, Jimenez-Shahed J, Leckman JF, et al. Efficacy and Safety of Deep Brain Stimulation in Tourette Syndrome: The International Tourette Syndrome Deep Brain Stimulation Public Database and Registry. JAMA neurology 2018;75(3):353-359.
- Wu SW, Maloney T, Gilbert DL, et al. Functional MRI-navigated repetitive transcranial magnetic stimulation over supplementary motor area in chronic tic disorders. Brain stimulation 2014;7(2):212-218.
- Kumar A, Duda L, Mainali G, Asghar S, Byler D. A Comprehensive Review of Tourette Syndrome and Complementary Alternative Medicine. Current developmental disorders reports 2018;5(2):95-100.
- Yu J, Ye Y, Liu J, Wang Y, Peng W, Liu Z. Acupuncture for Tourette Syndrome: A Systematic Review. Evidence-based complementary and alternative medicine : eCAM 2016;2016:1834646.
- Zheng Y, Zhang ZJ, Han XM, et al. A proprietary herbal medicine (5-Ling Granule) for Tourette syndrome: a randomized controlled trial. Journal of child psychology and psychiatry, and allied disciplines 2016;57(1):74-83.
- Kim DD, Warburton DER, Wu N, Barr AM, Honer WG, Procyshyn RM. Effects of physical activity on the symptoms of Tourette syndrome: A systematic review. European psychiatry : the journal of the Association of European Psychiatrists 2018;48:13-19.