Coordinadora del Capítulo:
Esther Cubo. Servicio de Neurología. Hospital General Yagüe, Burgos.
1 - Fenomenología de los tics.
Javier López del Val1, Berta Pascual Sedano.2
1.Unidad de Trastornos del Movimiento. Clínica Montpelier-Grupo HLA. Zaragoza. Email: Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
2.Unidad de Trastornos del Movimiento. Servicio de Neurología, Hospital de la Santa Creu i Sant Pau, Barcelona. E-mail: Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
1.1 DEFINICIÓN DE LOS TICS
Los tics son movimientos (tics motores) o sonidos (tics fónicos o vocales) relativamente rápidos, estereotipados, intermitentes y arrítmicos, caracterizados por una necesidad imperiosa de realizarlos y la aparición de una ‘tensión interior’ al intentar reprimirlos, con desaparición de la misma y sensación de alivio tras la realización del tic.1 Generalmente tienen una apariencia más coordinada que otros trastornos del movimiento y, aunque se presentan de anera involuntaria, con frecuencia parecen movimientos propositivos. Los tics motores son uno de los trastornos de movimiento más frecuentes. Se observan habitualmente en el contexto de enfermedades que cursan con tics primarios, recibiendo los nombres de tics transitorios, tics crónicos y síndrome de Tourette (ST).
1.2. CLASIFICACIÓN DE LOS TICS
Los tics se pueden clasificar dependiendo de sus características clínicas (fenomenología), del tipo de movimiento producido por los tics, o de su etiología.
1.2.1. Clasificación de los tics según sus características clínicas
Semiológicamente, cuando aparecen movimientos breves repetitivos, bruscos, involuntarios y estereotipados, se denominan tics motores. Y cuando se trata de sonidos, los tics se denominan tics fónicos o vocales. Ambos tipos afectan al desarrollo normal de músculos agonistas o a su relación sinérgica. La división entre "motores y fónicos" en ocasiones puede parecer arbitraria, ya que ciertos sonidos se producen por el paso del aire por las vías aéreas superiores (nariz, boca, garganta) al contraerse la musculatura laríngea, faríngea, respiratoria o bucal, pero en otras ocasiones los tics fónicos son claramente vocales y dependientes de la emisión irrefrenable de palabras, frases o insultos (coprolalia). Tanto los tics motores como los fónicos pueden ser simples o complejos, más elementales o más elaborados dependiendo del número de músculos implicados. Los tics simples afectan a un solo grupo muscular y provocan un movimiento breve a modo de sacudida, o un solo sonido sin sentido. Desde el punto de vista clínico, se han descrito múltiples y diferentes tipos de tics, que pueden aparecer de forma combinada entre sí. En la tabla 1 se describen los tics más comunes de cada tipo.
| Tabla 1.1 Clasificación clínica de los tics (adaptada de Novotny et al 2018).2 | |||
|---|---|---|---|
|
Simple |
Motor |
El tic afecta a un solo músculo o grupo de músculos |
Movimientos de ojos (parpadear, levantar la/s ceja/s, desviar ojos), de nariz, de lengua (protrusión), o cara (muecas), de boca, de cuello (estirar o sacudir la cabeza); de hombro (encogimiento), de manos o brazos (cerrar puño); de pierna, pie o dedo gordo (flexionar cadera, sacudir piernas, dar patadas, extender rodillas, dorsiflexionar el pie, hacer rizos con el dedo); de abdomen, tronco o pelvis (empujar pelvis, apretar nalgas) |
|
Fónico |
Sonidos o ruidos aislados, sin significado lingüístico |
Sorber (‘sniffing’), gruñir, carraspear o aclararse la garganta, chillar, gritar, gruñir, rechinar dientes, bufar, soplar, toser, silbar, chasquear lengua, gemir, eructar, hipar. |
|
|
Complejo |
Motor |
Implican a varios grupos musculares. Movimientos coordinados que semejan gestos o actos motores normales, pero inadecuados por el momento en que se realizan. De apariencia involuntaria o intencionada |
Tocar a otra persona, palpar, palpar, tirar, morder, doblar o girar el tronco, giros sobre un pie, saltar, patear, oler objetos, tocarse la nariz, escupir, asustarse de modo exagerado, agacharse, hacer gestos obscenos con las manos o tocarse genitales (copropraxia), imitar gestos o acciones de otro (ecopraxia) o realizar conductas autolesivas [mordisquearse de manera lesiva labios, mejillas o uñas, golpearse partes del cuerpos (dedos, rodillas, codos, ‘eye poking’)]. |
|
Fónico |
Pronunciación de palabras o frases con o sin sentido o significado lingüístico |
Emitir insultos, obscenidades o blasfemias (coprolalia), repetir sonidos, palabras o frases de otra persona o lo que se dice en la TV (ecolalia), repetir las propias palabras, en especial la ultima sílaba (palilalia), emitir palabras ininteligibles, tararear, tartamudear, hacer ruidos de animales. |
|
1.2.2 Clasificación de los tics según el tipo de movimiento
Los tics motores simples, según la mayor o menor brevedad del movimiento, pueden clasificarse en tics clónicos, distónicos, tónicos/tensionales. También se han descrito tics tremóricos y tics más complejos que no se adscriben a ningún trastorno del movimiento específico. La definición de cada uno de ellos se expone en la tabla 2.
| Tabla 1.2 Clasificación de los tics según el tipo de movimiento |
|---|
|
. Tics clónicos y mioclónicos: contracciones musculares breves (habitualmente < 100 ms), rápidas y bruscas. Por ejemplo: parpadeo, movimientos nasales, cefálicos o apendiculares bruscos . Tics distónicos: contracciones musculares sostenidas (> 300 ms), lentas, de torsión, o forzando una postura. Por ejemplo:cierre de párpados, movimientos oculógiros, torticollis, rotación del hombro . Tics tónicos o tensionales: similares a los distónicos pero de mayor duración (> 500 ms). Contracciones isométricas, sostenidas y prolongadas de ciertos músculos (brazos, abdomen, piernas) para aliviar una tensión interna. Dentro de estos tics se pueden englobar los tics bloqueantes: repentinas y completas interrupciones de la actividad motora sin pérdida de conocimiento. . Tics tremóricos: movimientos oscilatorios en manos (reposo y/o postural), simulando temblor . Tics bizarros/complejos: movimientos inusuales que no siguen el patrón de ningún trastorno del movimiento específico. |
1.2.3. Clasificación según su etiología
De modo general, los tics se clasifican también en tics fisiológicos y patológicos, los cuales a su vez se dividen en primarios y secundarios, pues además de en el ST, pueden aparecer en una variedad de enfermedades neurológicas. (2).
| Tabla 1.3. Clasificación etiológica de los tics |
|---|
|
TICS FISIOLÓGICOS: manierismos y gesticulaciones TICS PATOLÓGICOS Primarios Síndrome de Tourette . Tics transitorio motor y/o fónico (< 1 año evolución) . Tics crónicos, motores o fónicos simples (> 1 año evolución) . Tic esporádico crónico (único) de comienzo en el adulto
Secundarios (tourettismo) Heredodegenerativos: neuroacantocitosis,distonías primarias, PKAN, enfermedad de Huntington Tóxicos y drogas: monóxido de carbono (CO), estimulantes del SNC (anfetaminas, metilfenidato, pemolina, cocaína). Farmacológicos: dopaminérgicos, carbamacepina, fenitoína, lamotrigina, fenobarbital. Infecciones: encefalitis (viral, HIV, Lyme), corea de Sydenham. Alteraciones del desarrollo: cromosomopatías (Down, síndrome del x frágil, encefalopatías). Miscelánea: traumatismos, trastornos del espectro autista. OTRAS CONDICIONES RELACIONADAS CON LOS TICS Estereotipias Trastornos del espectro autista Trastorno por déficit de atención con hiperactividad (TDAH). Trastorno obsesivo-compulsivo. Síndromes de sobresalto. |
1.3. CARACTERISTICAS DIFERENCIALES DE LOS TICS
1.3.1 Impulso premonitorio
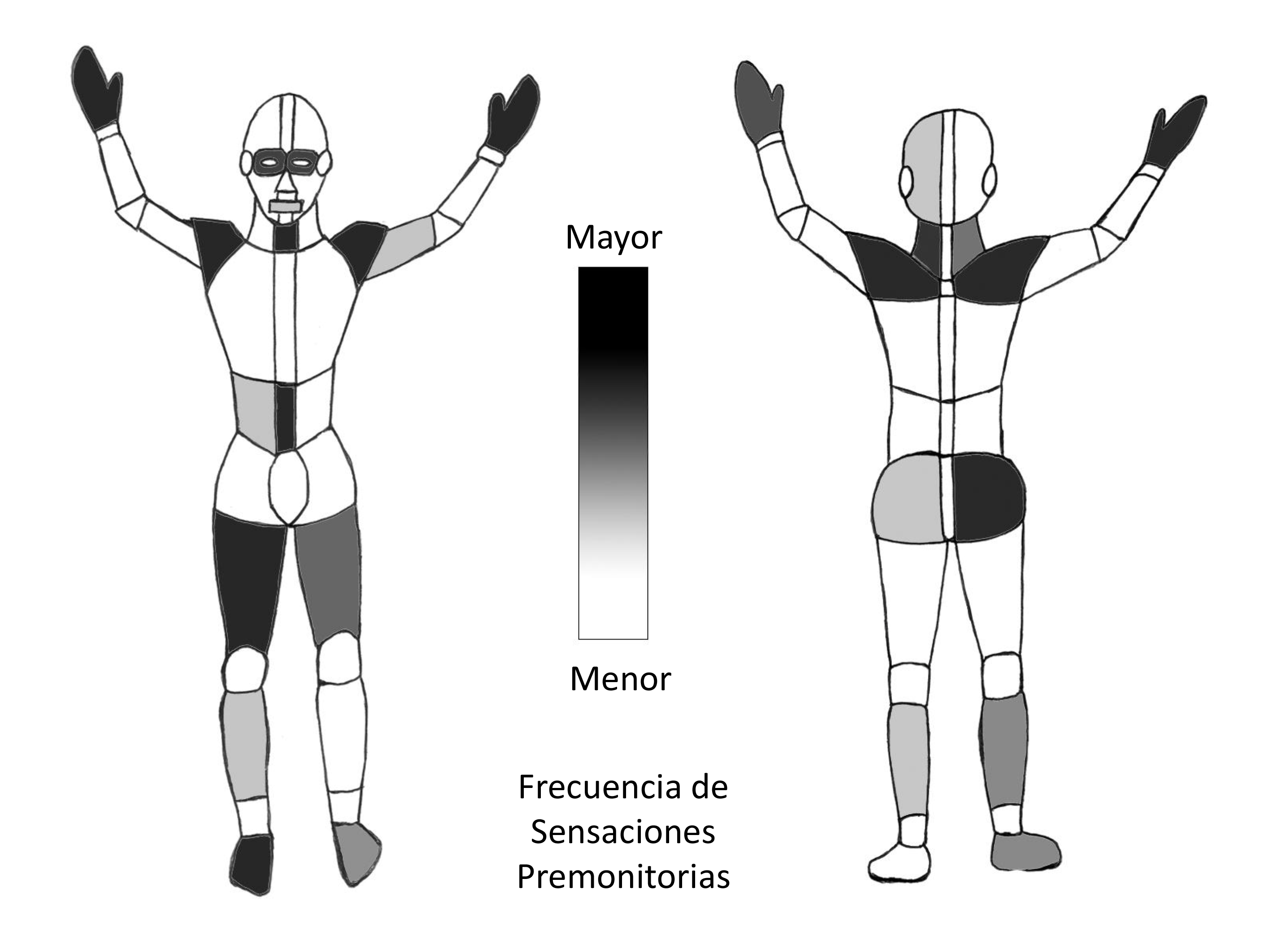
El impulso premonitorio (‘premonitory urge’) – también llamado urgencia premonitoria –consiste en una sensación de tensión interna focal o generalizada que lleva a la necesidad irrefrenable de realizar movimientos (tics motores) o sonidos (tics fónicos), y que se alivia con la realización del tic.3,4 Se presenta en más del 80% de los pacientes con tics, y a menudo es difícil de reconocer en niños menores de 10 años.5
Esta experiencia sensorial previa al tic puede ser táctil, térmica (calor), de presión (pinchazo), o en forma de fenómeno psíquico, con ansiedad creciente. Ejemplos frecuentes son la sensación de hormigueo o quemazón en los ojos antes de parpadear, tensión en el cuello que se alivia al moverlo, falta de aire o cosquilleo que pueden preceder a un estornudo, o picor de garganta antes de toser. También se han descrito otros impulsos premonitorios más difíciles de precisar y menos específicos, como ansiedad, ira y miedo. Las zonas corporales habituales donde se manifiesta el impulso premonitorio están representadas en la figura 1. Las localizaciones más frecuentes son las palmas de la manos, los hombros, la garganta y los muslos, un 40% de los pacientes la localizan exclusivamente en el músculo, y el resto en las articulaciones o en la piel (en este caso, se trata de un impulso premonitorio cutáneo, al que muchos autores denominan tic sensitivo).5
(Insertar Figura 1 aquí) Figura 1: Localización del impulso premonitorio
Las percepciones, sensaciones y emociones que preceden a la realización de un tic motor son puramente involuntarias; sin embargo aproximadamente un 70% de los pacientes admiten que los tics los realizan como respuesta a una “necesidad irresistible” de ejecutarlos para aliviar las sensaciones molestas premonitorias.6 El fenómeno de la sensación premonitoria se ha intentado utilizar para una posible intervención cognitiva-conductual de los tics.7
1.3.2 Hipersensibilidad multimodal/Ecofenómenos
Consiste en la existencia de un nivel de sensibilidad aumentado a los estímulos externos, percibidos como factores desencadenantes y/o agravantes de los tics.8 Se trata –al igual que el impulso premonitorio- de un fenómeno sensorial. Por ejemplo, los pacientes con ecofenómenos sufren tics complejos que incluyen la copia de movimientos realizados por otros (ecopraxia) o sonidos emitidos por otros (ecolalia)9. Asimismo, un 70% de los pacientes con ST presentan una sensibilidad aumentada a los estímulos táctiles, auditivos y/o visuales.
1.3.3 Capacidad de supresión
En contraste con otros movimientos anormales, los tics pueden disminuirse o inhibirse temporalmente mediante la concentración o con tareas físicas y mentales. Cuando se consigue esta inhibición o supresión, se produce por un breve tiempo, y a menudo se sigue de un incremento de la intensidad de los tics mayor de la habitual, lo que se conoce como fenómeno “rebote”.2,10 Existe una clara variabilidad interindividual en la supresión de los tics; la mejor supresión se consigue en los pacientes de mayor edad y con los tics más frecuentes, pero no se relaciona con la comorbilidad psiquiátrica, la medicación psicotrópica, la severidad del impulso premonitorio y la puntuación subjetiva de supresión de los tics.11
1.3.4 Otros factores agravantes de los tics
Los tics se caracterizan por ser muy influenciables por diferentes situaciones, pudiendo aumentar (tanto en cantidad como en calidad) con el estrés, la ansiedad, la excitación, la fatiga, el aburrimiento, el calor o con la toma de determinados fármacos dopaminérgicos o estimulantes del sistema nervioso central. Sin embargo, muchos pacientes no pueden identificar ningún factor agravante.12 Algunas personas sólo presentan tics en casa o al estar solas,13 y otras ni tan siquiera son conscientes de sus tics. Una gran proporción de padres describen un empeoramiento de los tics a la vuelta de la escuela, posiblemente debido a una supresión consciente o inconsciente de los tics durante el tiempo de escuela, seguido por una “liberación” de los tics.12 El patrón típicamente variable de los tics puede estar influido por su severidad, por la capacidad de disimular o camuflar el tic, y por la interferencia que provoca en las actividades de la vida diaria y en la autoestima.
1.3.5 Otras características de los tics
Al contrario de lo que sucede en otros trastornos del movimiento -que desaparecen por completo en el sueño-, los tics motores y vocales pueden persistir en todas las fases del sueño.13 En la tabla 4 se resumen las características peculiares de los tics.
| Tabla 1.4 Características semiológicas de los tics |
|---|
|
Impulso premonitorio: tensión interna focal o generalizada que lleva a la necesidad de realizar tics motores o fónicos, y que se alivia con la realización del tic. Hipersensibilidad multimodal: sensibilidad aumentada a los estímulos externos (táctiles, auditivos y/o visuales), que actúan como desencadenantes y/o agravantes de los tics. Capacidad de supresión/Supresibilidad: Inhibición temporal del tic mediante la concentración y durante un breve tiempo, seguido de un aumento de la intensidad del tic (fenómeno de rebote). Factores agravantes de los tics: Estrés, ansiedad, excitación, fatiga, aburrimiento, calor, estimulantes dopaminérgicos u otros estimulates del sistema nervioso central Otras características: Posibilidad de persistencia durante el sueño |
1.5. LOS TICS EN EL SÍNDROME DE TOURETTE
En esta entidad, la edad media a la que aparecen los primeros tics motores es a los 4-8 años (edad media = 7 años), y tienden a preceder al desarrollo de los tics fónicos en 1-2 años.2,14 Los tics motores siguen una distribución rostro-caudal, siendo más frecuentes a nivel de la cara, cabeza, cuello y cintura escapular. Los tics más comunes son el cierre de párpados y otros movimientos alrededor de los ojos, movimientos en la boca, nariz, cabeza y hombros. Con menor frecuencia se localizan también en brazos, torso, abdomen y piernas. Los tics fónicos más frecuentes son aclaramiento de garganta, olfateo, tos (tics que con frecuencia se confunden con manifestaciones alérgicas) y chirridos simples. El impulso premonitorio y la capacidad de suprimir los tics aparecen antes de los 10 años.15 Con frecuencia los tics en el ST aumentan de intensidad hacia los 10-12 años y pueden mantenerse con la misma intensidad durante la adolescencia.7
En los pacientes con mayor gravedad y/o duración de la enfermedad, los tics adquieren mayor complejidad, y se producen estiramientos de brazos, tocamientos, saltos, retorcimientos y otros movimientos complejos. En ocasiones estos tics están unidos en una secuencia, de modo que uno de ellos se sigue inmediatamente de otros. Los ecofenómenos (ecolalia y ecopraxia) ocurren en casi la mitad de los pacientes con ST, y suelen asociarse con personalidad obsesiva (se debe tener en cuenta que en los niños puede haber ecolalia o ecopraxia como fenómenos normales si se producen en un contexto adecuado, a diferencia del ST). La coprolalia es un síntoma caractarístico del ST, si bien se presenta sólo en aproximadamente el 10% de los pacientes. Es más frecuente en varones, suele aparecer unos cinco años después del inicio de los tics y tiende a asociarse con conductas sociales inapropiadas como escupir, olisquear objetos, comportamientos sexuales inapropiados.16,17
Independientemente de su complejidad, los tics mantienen sus características estereotipadas y repetitivas. Sin embargo, cambian a lo largo del tiempo, con lo que un tic suele ser reemplazado por otro. Además, pueden fluctuar en intensidad tanto de hora en hora como de día en día o de semana en semana, creando lo que se denomina un patrón creciente y menguante (waxing and waning).16 Los tics mejoran en muchos pacientes al iniciar la edad adulta, de modo que a esa edad aproximadamente un tercio queda libre de tics.19
El llamado “ST puro”, -caracterizado únicamente por la presencia de tics- es una rara condición, pues la mayoría de los pacientes con ST sufren comorbilidades neuropsiquiátricas que suelen alcanzar su mayor gravedad en la adolescencia tardía. Los pacientes con ST tienen una alta comorbilidad con el trastorno por déficit de atención con hiperactividad (TDAH), trastorno obsesivo compulsivo (TOC), conductas impulsivas y/o autolesivas, ataques de rabia/ira, depresión, ansiedad, alteraciones del aprendizaje y rasgos leves de trastornos del espectro autista. Estas complicaciones tienen un alto impacto en la calidad de vida, en ocasiones más importante que el generado por los propios tics. Todas estas comorbilidades y complicaciones se abordarán con mayor detalle en otros capítulos de este consenso.
Merece la pena mencionar las conductas autolesivas forman parte en la mayoría de pacientes de tics complejos en los que el paciente necesita sentir dolor para calmar la ansiedad anticipatoria. En diversos estudios la presencia de conductas autolesivas correlaciona de manera independiente con otros tics motores/fónicos complejos y con coprofenómenos. La gravedad de los tics en el ST se ha asociado con la presencia del impulso premonitorio, coprofenómenos, ecofenómenos, palifenómenos y con el número de comorbilidades psiquiátricas, pero no con la edad de inicio.15
Por último, es importante tener en cuenta que además de los tics, aproximadamente un 5% de los pacientes con ST tienen trastornos del movimientos adicionales. Estos movimientos suelen ser secundarios a los fármacos usados para el tratamiento del ST, los cuales pueden provocar tanto de manera aguda como en forma de síndrome tardío los siguientes trastornos del movimiento: acatisia, distonía, corea, parkinsonismo o temblor. Este amplio espectro de movimientos pueden diagnosticarse erróneamente como tics o como exacerbación de los tics.20
1.6 DIAGNÓSTICO DE LOS TICS
Los trastornos por tics se diagnostican generalmente en base a una cuidadosa anamnesis de la historia personal y familiar, y tras una exploración neurológica dirigida. Las preguntas más importantes que un clínico se debe hacer ante la presencia de tics son las siguientes:
¿Estamos realmente ante tics? (diagnóstico diferencial)
¿Cuántos tipos de tics muestra el paciente?
¿Cuál es la frecuencia de presentación?
¿Cuál es su intensidad?
¿Qué complejidad tienen?
¿Cuál es la distribución en los segmentos corporales?
¿Qué capacidad tiene el paciente para suprimirlos?
¿Cómo interfieren los tics en las actividades cotidianas?
La escala global de gravedad de tics de Yale (YGTSS, Yale Global Tic Severity Scale) es la herramienta estándar validada que se utiliza en la mayoría de los estudios de ST y una de las escalas recomendadas por la MDS para la evaluación de los tics (Movement Disorders Society) en la evaluación de los tics.21 Mediante su uso, se puede detectar con mayor detalle los tipos de tics, su número, frecuencia, intensidad, complejidad y gravedad, la edad a la que el paciente los sufre o sufrió, así como la interferencia y deterioro de la calidad de vida provocadas por los tics. El resultado puede obtenerse tanto en forma de puntuación total de la gravedad de los tics (0-5) o en puntuación total de la YGTSS (0-100).22 Las propiedades psicométricas de la YGTSS traducida al español fueron validadas en 2008.23
Tanto el impulso premonitorio como la característica capacidad de supresión de los tics son importantes indicadores diagnósticos. Para evaluar el impulso premonitorio, la mayoría de estudios clínicos usan la Escala de Impuso Premonitorio para Tics (PUTS, Premonitory Urge for Tics Scale), cuestionario autoadministrado desarrollado específicamente para medir la gravedad de este síntoma.24 La Tarea de Supresión del Tic puede ser una herramienta útil para medir el grado en el que los tics pueden ser inhibidos.11
1.7 DIAGNÓSTICO DIFERENCIAL DE LOS TICS
Las características peculiares de los tics (impulso premonitorio, hipersensibilidad multimodal y capacidad de supresión), así como su persistencia durante el sueño ayudan a distinguirlos de otros trastornos del movimiento, y su aparente intencionalidad es un hecho útil para diferenciarlos de otros comportamientos repetitivos, como mioclonias, sacudidas funcionales o estereotipias.
Los principales trastornos del movimiento (la mayoría de tipo hipercinético) y entidades que se pueden confundir con tics se describen brevemente en la Tabla 5.
| Tabla 1.5 Diagnóstico diferencial semiológico de los tics con otros trastornos del movimiento |
|---|
|
Mioclonias: Contracciones o sacudidas breves, súbitas, rápidas, segmentarias o generalizadas. No se pueden suprimir con la voluntad. Pueden como los tics persistir durante el sueño. Es el diagnóstico diferencial que más dificultad suele plantear con los tics, pues muchos de ellos son de tipo clónico o mioclónico, como por ejemplo, los tics faciales (parpadeo, movimientos nasales), cefálicos o apendiculares bruscos. Crisis epilépticas focales (anteriormente parciales): Contracciones musculares bruscas, tónicas o clónicas paroxísticas, que desplazan segmentos corporales, y que se deben distinguir de los tics motores clónicos y tónicos fundamentalmente. Las crisis epilépticas focales con alteración de la conciencia (anteriormente parciales complejas) se deben distinguir de los tics bloqueantes. Distonía: Contracciones sostenidas y repetitivas que generan posturas o movimientos anormales, en ocasiones de tipo espasmódico. Puede ser focal, segmentaria, generalizada o hemicorporal.El parpadeo repetitivo o cierre forzado de los ojos puede ser una forma focal de distonía craneal (blefaroespasmo) o un tic motor simple. Los tics distónicos y sobre todo los tónicos o tensionales (de mayor duración) pueden ser difíciles de distinguir de la distonía. A diferencia de los tics, la distonía no se precede de unimpulso premonitorio y su capacidad de supresión es mucho menor que en el tic Discinesia paroxística cinesigénica: Crisis de coreoatetosis uni o bilateral o distonía desencadenadas por movimientos repentinos, sobresaltos o hiperventilación Se pueden confundir con tics complejos. Pueden tener cierto impulso premonitorio. Opsoclonus: Se debe diferenciar de los movimientos oculógiros provocados por un tipo de tic distónico Temblor: Movimiento rítmico y oscilatorio, de reposo, de acción o intencional. Se diferencia de los raros tics tremóricos en que no tiene impulso premonitorio, aunque el temblor puede suprimirse parcialmente en ocasiones. Corea: Movimiento irregular, sin propósito, arrítmico, brusco, rápido, no sostenido, generalmente migratorio y sinuoso, que puede aparecer en cabeza, cuello, tronco o extremidades. Tiene cierto grado de supresión, pero menor que los tics Balismo: Movimientos de gran amplitud en extremidades, proximales, y a menudo violentos, como si se lanzara la extremidad. Generalmente aparecen en una mitad del cuerpo (hemibalismo). El diagnóstico diferencial es con tics motores mioclónicos Atetosis: Movimientos reptantes, que afectan mas a zonas distales Discinesia tardía: Movimientos repetidos estereotipados en músculos labiales, linguales y peribucales, de masticación, lamida de labio o protrusión lingual. Transitorios o persistentes, pueden aumentar con ansiedad y estrés Síndrome de piernas inquietas: Sensación desagradable en las extremidades que induce a una urgencia irresistible de moverlas, se alivian con el movimiento y de modo característico aparece por la tarde o por la noche Acatisia: Comportamiento motor inquieto asociado a sensación mental de intranquilidad y angustia. Puede confundirse con un tic motor complejo Estereotipias: Movimientos sin propósito o ritualistas, muy uniformes, repetitivos, coordinados y presentes durante periodos prolongados de tiempo. Se suprimen por estímulos externos y no se acompañan de impulso premonitorio. Se deben diferenciar de los tics complejos, que carecen del grado de repetición de las estereotipias Compulsiones: Actos realizados con propósito en respuesta a una idea obsesiva; una compulsión puede ocasionar un movimiento o sonido complejo y repetitivo debido a la necesidad irresistible de hacer un movimiento o emitir un sonido por miedo a que si no se realiza ocurrirá algo negativo.Su ejecución produce un alivio mental, ya que se acompañan de una sensación vaga de inquietud si no se lleva a cabo. Puede ser difícil de distinguir de un tic motor complejo (tic cognitivo o tic-like obsesión/compulsión), debido a la dificultad del paciente para verbalizar sus sentimientos (los tics carecen de ideas obsesivas) Manierismos: Actos motores complejos o sonidos peculiares que el sujeto realiza en determinadas situaciones. Al contrario que las estereotipias, siempre tienen un propósito, y son distintos a los gestos habituales propios de cada cultura. Manipulaciones habituales del cuerpo: Son comportamientos estereotipados, resultan gratificantes y producen alivio emocional en respuesta a aburrimiento, cansancio o ansiedad (como morderse las uñas, chuparse los dedos, mover una pierna o enroscarse el pelo). Perseveración: Persistencia de un acto motor iniciado con un objetivo, que desaparece una vez alcanzado. Se asocia a enfermedades médicas Vocalizaciones o comportamientos desorganizados y absurdos en la esquizofrenia: se acompañan de ideas delirantes, síntomas cognitivo-conductuales negativos; su evolución suele ser hacia la disminución progresiva de la actividad. Trastorno funcional: Se debe hacer el diagnóstico diferencial en especial con los tics bizarros. |
1.8 Diagnóstico de las entidades que cursan con tics primarios
El diagnóstico de Síndrome de Tourette (ST) requiere -según los criterios actuales de la DSM-V,25 la presencia de al menos dos tics motores y uno o más tics fónicos durante al menos un año, con frecuencia casi diaria (a veces muchas veces al día, y por lo general en ataques), iniciados antes de los 18 años y tras la exclusión de causas secundarias de tics, como consumo de medicamentos, otras drogas, o afecciones que puedan causar tics (por ejemplo, enfermedad de Huntington o encefalitis postvírica). No es necesario que los tics hayan coincidido en el tiempo.
El diagnóstico de trastorno por tics persistente (crónico) motor o fónico incluye todos los criterios para ST, pero los pacientes únicamente manifiestan tics motores o vocales, pero no tics de ambos tipos.
Para el diagnóstico de trastorno por tics transitorio, se debe haber tenido uno o más tics motores o tics fónicos por no más de 12 meses seguidos; el resto de criterios son similares al del ST. Este trastorno es tres veces más frecuente en niños que en niñas. Los tics suelen empezar alrededor de los 6 años y mejoran espontáneamente en la mayoría de los casos, si bien en algunos pacientes pueden persistir hasta la vida adulta en forma transitoria, o pasar a ser crónicos. No hay una diferencia fisiopatológica clara entre estos tres trastornos.
Además, dentro de los trastornos por tics, en el DSM-V existen dos clasificaciones más: Otros trastornos por tics especificados, cuando el trastorno por tics causa una afectación significativa a nivel social, ocupacional o en otras áreas de adaptación, pero no cumple los criterios completos de las categorías diagnósticas aceptadas dentro de los trastornos por tics o por otros trastornos del neurodesarrollo, y cuando se especifica la razón concreta del incumplimiento de estos criterios. El diagnóstico se efectuaría expresando ‘otro trastorno de tics especificado’, seguido de la razón especifica (por ejemplo, ‘de inicio posterior a los 18 años’), y trastornos por tics no especificados, cuando no se especifica la razón concreta del incumplimiento de los criterios; incluye aquellos casos en los que no existe una información suficiente para realizar un diagnóstico más específico.
2 - BASES NEUROFISIOLÓGICAS Y NEUROANATÓMICAS DE LOS TICS
Juan Francisco Martín Rodríguez1, Ángel Sesar2, Pablo Mir1,3
1.Unidad de Trastornos del Movimiento, Servicio de Neurología y Neurofisiología Clínica, Instituto de Biomedicina de Sevilla, Hospital Universitario Virgen del Rocío/CSIC/Universidad de Sevilla, Seville, Spain.
2.Unidad de Trastornos del Movimiento. Servicio de Neurología. Complejo Hospitalario Universitario de Santiago de Compostela
3.Centro de Investigación Biomédica en Red sobre Enfermedades Neurodegenerativas (CIBERNED), Madrid, Spain.
2.1 INTRODUCCIÓN
El ST en un trastorno de inicio en la infancia caracterizado por la presencia de múltiples tics motores y al menos un tic vocal durante al menos 1 año.26 La expresión de los tics varía desde acciones motoras o vocales breves, recurrentes y no rítmicas (tics simples) a secuencias motoras o vocales complejas (tics complejos).27 Los tics a menudo se asocian con trastornos psiquiátricos como el TOC, el TDAH o la depresión.28 Por lo tanto, la expresión fenotípica del ST es variado ya que puede ir desde simples tics a una asociación más compleja de tics y las mencionadas comorbilidades psiquiátricas.
Los tics son movimientos hipercinéticos que se distinguen de otros movimientos por su variedad en semiología, duración y por su capacidad de modulación a través de mecanismos de control cognitivo. Una característica de los tics es que son movimientos estereotipados y repetitivos que tienden a cambiar de tipo y ubicación anatómica durante largos períodos de tiempo. Aunque los circuitos relacionados con los tics no se conocen completamente, existen evidencias provenientes de estudios de neuroimagen y neurofisiológicos que indican la existencia de alteraciones funcionales y neuroanatómicas en los circuitos motores cortico-basales.
2.2 BASES NEUROANATÓMICAS DEL SÍNDROME DE TOURETTE
2.2.1. Circuitos córtico-subcorticales implicados en el tic
La patogenia de la heterogeneidad clínica del ST resulta aún menos conocida. Los circuitos paralelos de los ganglios de la base, circuitos córtico-estriado-pálido-tálamo-corticales (CEPTC) que unen regiones específicas de la corteza frontal con estructuras subcorticales han proporcionado un marco para comprender las interconexiones neurobiológicas existentes entre el ST y sus múltiples comorbilidades.29,30 De acuerdo con los modelos clásicos de trastornos del movimiento, se postulaba que los ganglios basales influían en el comportamiento al modificar la excitabilidad cortical a través de la interacción entre la vía “directa” [estriado a globo pálido interno (GPi)] y la multisináptica vía "indirecta" [estriado al globo pálido interno (GPi), vía globo pálido externo (GPe) y núcleo subtalámico (NST)31. De acuerdo con este modelo, los trastornos hipercinéticos serían el resultado de una mayor excitabilidad cortical, debido a una reducción del efecto estimulador de la vía directa o un aumento en el efecto inhibitorio indirecto.
Sin embargo, otros estudios posteriores han demostrado que este modelo no aborda de manera completa la especificidad y complejidad de los tics. Esto ha dado lugar al desarrollo de otras hipótesis que involucran a los ganglios basales en un proceso de selección de acción, esto es, en una facilitación focalizada en los movimientos seleccionados y en una inhibición de patrones motores competitivos.32 Según este modelo, los tics serían reflejos de un aumento de la excitabilidad focal en el estriado, lo cual causaría una inhibición patológica de neuronas en el GPi y, a su vez, una desinhibición de las neuronas corticales.33
Recientemente, se han propuestos diversos modelos que explican la compleja interacción entre los aspectos motores (tics), los fenómenos sensoriales que los acompañan y las comorbilidades psiquiátricas comunes del ST. Las proyecciones corticales a los ganglios basales presentan una organización funcional y topográfica, lo cual ha llevado a la subdivisión funcional de los circuitos CEPTC en sensitivo-motores, asociativos y límbicos, que estarían implicados, respectivamente, en los aspectos motores, cognitivos y volitivos de la conducta.34 De acuerdo con este modelo de organización de los ganglios basales, se ha sugerido que los tics motores pueden ser el resultado de una alteración funcional en los circuitos premotores y motores, mientras que los trastornos del comportamiento pueden resultado de una disfunción en los circuitos asociativos y límbicos.35,36 Esta hipótesis se encuentra respaldada por varias líneas de evidencia. En modelos de primates, la alteración experimental de los circuitos premotores y sensitivo-motores producen movimientos anormales que se asemejan a los tics motores simples, 37,38 mientras que la alteración de los circuitos asociativos y límbicos dan como resultado, respectivamente, trastornos de la conducta parecidos a los tics complejos y compulsiones.38,39
2.2.2. Cambios estructurales en el Síndrome de Tourette
Se ha mostrado en numerosos estudios la existencia de alteraciones en los circuitos CEPTC, a diferentes niveles, en pacientes con ST (tabla 1). Los hallazgos identificados por estudios volumétricos de resonancia magnética (RM), utilizados para identificar cambios neuroanatómicos (particularmente subcorticales) en el ST, varían ampliamente. En la cohorte más grande hasta la fecha, Peterson y colaboradores,40 identificaron una disminución leve pero consistente en el volumen de los ganglios basales en más de 150 pacientes con ST. Subdividido por edad, el volumen reducido fue más evidente en el núcleo caudado de los niños, mientras que en adultos se evidenció una reducción más generalizada en todas las subdivisiones de los ganglios basales. Este hallazgo se vio respaldado por un estudio de gemelos que mostró que los hermanos más gravemente afectados tenían un caudado derecho más pequeño,41 y un estudio longitudinal que demostró que el volumen caudado en la infancia variaba inversamente con la gravedad del tic en la edad adulta.42 Por el contrario, no se pudieron observar diferencias en el volumen del caudado en los estudios que utilizan criterios de exclusión más estrictos para controlar los factores de confusión, aunque sí se mostró un aumento del volumen del putamen bilateralmente en los varones con ST.43 Este dato también se identificó utilizando una técnica de análisis de imágenes automatizada capaz de evaluar las diferencias en todo el cerebro en lugar de centrarse en áreas específicas seleccionadas (morfometría basada en vóxeles).44 También se ha observado una asimetría del putamen, no asociado a cambio en los volúmenes absolutos, pero los resultados no se han podido replicar y posiblemente estén afectados por el sexo.45,46
Los estudios de imagen con tensor de difusión (ITD) miden el movimiento de las partículas del agua y proporcionan varios índices que pueden reflejar cambios microestructurales cerebrales. Con esta técnica se han mostrado cambios microestructurales en el putamen en comparación con controles sanos.47 Este hallazgo no se replicó en un estudio posterior, aunque se identificó una correlación entre los parámetros de difusión y la gravedad de los tics en pacientes con ST.48
Los estudios neuropatológicos en el ST son escasos, aunque han proporcionado evidencia de alteraciones celulares en los ganglios basales que apoyan los estudios de neuroimagen. En un estudio con tamaño muestral pequeño (tres pacientes TS y cinco controles), Kalanithi y cols.49 encontraron un aumento en el número total de neuronas en el GPi asociado a una disminución en el número y densidad de las neuronas en el GPe y el caudado. La distribución de interneuronas GABAérgicas positivas para parvalbúmina también mostró un marcaje diferencial en pacientes con ST, con un porcentaje mayor de este marcaje en la región del GPi. Este mismo grupo confirmó sus hallazgos en dos pacientes adicionales y además demostró una disminución en las neuronas colinérgicas estriatales.50 Aunque estos resultados están limitados por el tamaño de la muestra y otros factores de confusión potenciales, incluidos los posibles efectos de la terapia farmacológica, se propone que estos hallazgos implican fuertemente las regiones asociativa y sensitivo-motoras de los ganglios basales en la patogénesis de ST.
Apoyando los hallazgos neuropatológicos, otros estudios han observado una implicación de las áreas paralímbicas y de asociación sensoriales en la generación del tic usando RM.51 Asimismo, se han observado cambios estructurales en la corteza frontal, córtex cingulado anterior, ínsula, parietal y temporal, mediante técnicas basadas en vóxel,52 región de interés,53 y mediciones de espesor cortical.54,55 También se han observado cambios estructurales en el estriado, globo pálido,40 y cerebelo,56 siendo éstas analizadas como regiones de interés. Los estudios de análisis basados en vóxeles también muestran cambios en el estriado,57 y mesencéfalo.58 Por último, los estudios que usan imágenes por difusión muestran alteraciones en el tálamo.47
2.2.3. Expresión fenotípica del ST asociada a alteraciones de circuitos corticales-subcorticales
La gravedad de los tics se ha correlacionado con el grosor de la corteza sensitivo-motora y áreas adyacentes frontales y parietales.54,55 Esta medida de gravedad también se ha relacionado con un incremento en el volumen de putamen ventral, usando técnicas basadas en vóxeles,57 así como con la orientación de la difusión talámica.47 Por el contrario, la presencia de comorbilidades psiquiátricas, como el TOC o el TDAH, se correlaciona con la reducción de volumen en el núcleo caudado anterior,40,42 y un aumento del volumen en la amígdala.59 Es interesante notar, el volumen del hipocampo se correlaciona tanto con la gravedad de los tics,57 como con la presencia de TOC y TDAH.59
En general, los resultados previos apoyan la hipótesis de la existencia de circuitos funcionalmente distinguibles involucrados en los tics y las comorbilidades que normalmente acompañan a ST. La detección de tales circuitos ha servido para identificar ciertos subgrupos clínicos, lo que podría tener repercusiones a la hora de la toma de decisiones sobre el abordaje terapéutico en cada caso.
Hay distintas líneas de evidencias que apoyan la hipótesis de que la expresión de distintos fenotipos asociados al ST se debe a alteraciones en circuitos específicos cortico-subcorticales. Por ejemplo, Worbe et al.60 muestran, en un estudio con medidas de espesor cortical, que la presencia de tics simples se asocia con una disminución del grosor cortical en áreas premotoras y sensitivo-motoras, mientras que la presencia de tics complejos se asocia con un adelgazamiento de las áreas premotoras (de mayor tamaño que lo observado para los tics simples), prefrontales y asociativas en corteza parietal. La presencia de comorbilidades se relaciona con alteraciones en regiones distintas a las descritas para los tics. Por ejemplo, la presencia de TOC se asocia a una alteración morfológica en el hipocampo y una reducción del espesor del córtex cingulado. Este estudio no incluyó pacientes con TDAH como comorbilidad al ST. Además, la gravedad de los tics se asoció de manera negativa al grosor cortical en regiones frontales, parietales y temporales, mientras que la gravedad del TOC correlacionó negativamente con el grosor del área cingulada anterior y positivamente con regiones prefrontales.
|
Tabla 2.1 Principales alteraciones estructurales encontradas en pacientes con ST. | |||
|---|---|---|---|
|
Estudio |
Participantes |
Rango de edad de los pacientes (años) |
Hallazgos principales |
|
Estudios con medidas de espesor cortical |
|||
|
Worbe et al.60 |
60 ST (tics simples: 21, tics complejos: 22, tics+TOC: 17) y 30 CS |
media 30,3 (todos >18) |
Comparación ST vs CS: disminución grosor cortical en regiones motoras y premotoras, prefrontal dorsolateral (I) y áreas ventro-lateral y orbitofrontal lateral (D). Tics simples se asocian a disminución del grosor en corteza motora primaria (región de mano y cara). Tics complejos se asocian a disminución del grosor en áreas premotoras y prefrontales y parietales. TOC se asocia con alteración morfológica del hipocampo y tendencia a una disminución del grosor de córtex del cíngulo anterior. YGTSS se asocia negativamente con grosor cortical en áreas motoras, premotoras, prefrontal ventro-lateral y regiones adyacentes orbitofrontales. Y-BOCS muestra tendencia a correlación negativa grosor en córtex cingulado anterior dorsal y ventral (I). Correlación negativa con grosor de áreas premotoras mediales. |
|
Fahim et al.55 |
34 ST (sin neurolépticos) y 32 CS |
10-25 |
Comparación entre grupos: espesor cortical reducido en áreas sensitivo-motores (I), parietal, órbito-frontal (D) en ST. Correlación negativa con grosor cortical: YGTSS con corteza órbito-frontal (D) y precentral (I); niños ST > ST niñas; escala Rush con giro postcentral (I); niños ST > niñas ST; Edad con corteza órbito-frontal, con reducción en giro postcentral (I), y espesor cortical reducido en corteza precentral (I) y parietal. |
|
Sowell et al.54 |
25 ST (TDAH: 4, TOC: 5) y 35 CS |
7-18 |
Comparación entre grupos: reducción del espesor de las áreas sensitivo-motores y parietales. YGTSS inversamente correlacionado con corteza frontal dorsal, parietal (I), frontal medial (I), pre- y post-central y occipital (I). |
|
Medidas volumétricas y de regiones de interés |
|||
|
Tobe et al.56 |
163 ST (TDAH: 48, TOC: 57, medicación: 52%) y 147 CS |
6-60 |
Volumen reducido en el cerebelo, bilateral en ST debido principalmente a un descenso de SG en el lóbulo posterior y vermis cerebelosa. Gravedad del tic y ejecución en test de tapping correlaciona con la reducción del volumen. Sexo: hombres presentan una reducción mayor del volumen comparado con las mujeres. TOC se asocia con un aumento relativo de estas regiones en proporción a la gravedad de los síntomas TOC. No se asocia al TDAH, ni a la medicación. |
|
Peterson et al.59 |
154 ST (TDAH: 52, TOC: 58, con medicación: 46%) y 128 CS |
6-63 |
Mayor volumen (giro dentado) y amígdala (núcleo central y región basolateral) en ST. Estas regiones presentan mayores volúmenes en niños que en adultos comparado con controles. La gravedad del tic, TOC y TDAH correlaciona de manera inversa con el volumen en estas regiones, tanto en adultos como en niños. |
|
Lee et al. 61 |
18 TS (sin medicación), 16 CS |
7-14 |
Mayor volumen en tálamo (I) en ST. |
|
Bloch et al. 42 |
43 ST (TDAH: 8, TOC: 15, con medicación: 21). Sin CS. |
Primera RMN: 9-14; segunda RMN: 16-23 |
En niños con ST, el volumen estriatal no correlaciona con la gravedad de los tics. En adultos con ST, la disminución del volumen del caudado y putamen (D) predice la gravedad del tic. La disminución del volumen del caudado correlaciona significativamente e inversamente con la gravedad del TOC. |
|
Kates et al. 62 |
13 ST, 13 TDAH y 13 CS |
7-12 |
En TS, disminución del volumen de la SB profunda frontal. En TDAH, descenso del volumen prefrontal tanto en SG como en SB. |
|
Fredericksen et al.63 |
11 ST, 14 ST con TDAH, 12 TDAH (todos evaluados tras retirarle 48h la medicación) y 26 CS |
7-15 |
En TS, aumento de SB en la corteza frontal (D). En TDAH, descenso del volumen frontal. |
|
Peterson et al.53 |
155 ST (TDAH: 36, TOC: 62, con medicación: 46%) y 131 CS |
6-63 |
Niños con ST: Niños – mayor volumen prefrontal dorsal, parieto-occipital y occipital inferior; menor volumen córtex premotor, orbitofrontal y cingulada subgenual; Niñas – mayor volumen prefrontal dorsal y occipital inferior. Adultos con ST: Hombres – mayor volumen premotor y parieto-occipital. Mujeres – menor volumen prefrontal dorsal y parieto-occipital. Gravedad de los tics correlaciona con volumen orbito-frontal y parieto-occipital. |
|
Zimmerman et al. 46 |
19 ST (TDAH: 8) y 21 CS |
7-15 |
No diferencia en el tamaño de los ganglios basales de los pacientes con ST en comparación con los CS. |
|
Singer et al.45 |
37 ST (TDAH: 18) y 18 CS |
7-16 |
No diferencia en tamaño de ganglios basales en pacientes con ST. ST con TDAH presentan aumento volumen en núcleo lenticular (D). |
|
Morfometría basada en vóxeles |
|||
|
Muller-Vahl et al.52 |
19 ST (sin medicación, sin comorbilidades psiquiátricas) y 20 CS |
17-60 |
Disminución SG en el giro cingulado anterior, áreas sensitivo-motoras, caudado (I) y giro postcentral (I). Disminución SB en el giro inferior frontal (D), áreas sensitivo-motoras (I). Gravedad del tic se correlaciona negativamente con estructuras orbitofrontales, giro cingulado (D), corteza parieto-témporo-occipital. |
|
Roessner et al.64 |
38 ST (sólo tics, sin medicación) y 38 CS |
10-15 |
No diferencias con CS. |
|
Ludolph et al.57 |
14 ST (con medicación: 4), 15 CS |
12,5 de media |
Aumento SG en putamen ventral bilateral Disminución SG en el giro hipocampal izquierdo YGTSS correlaciona con cambios en SG. |
|
Garraux et al. 58 |
31 ST (TDAH: 10, TOC: 12, depresión mayor: 6, adicción a sustancias: 6) y 31 CS |
17-49 |
Aumento SG en mesencéfalo (I). No diferencias en ganglios de la base. |
|
Imágenes con tensores de difusión |
|||
|
Govindan et al.65 |
15 ST (con TDAH y/o TOC, con medicación: 10) y 14 CS |
7-17 |
SB: valor de difusión aumentado en las vías cortico-estriatales, incluyendo la cápsula interna (I) y fascículo subcalloso. SG: aumento difusión en córtex órbito-frontal e insular (I), putamen (I). Gravedad del tic se asocia negativamente con los valores de difusión en cápsula externa (I). |
|
Neuner et al.66 |
28 ST (TDAH: 3, TOC: 4, con medicación: 15) y 19 CS |
18-55 |
Disminución de la AF e aumento de la difusión radial en el tracto corticoespinal y cápsula interna. Disminución AF en el cuerpo calloso. |
|
Makki et al. 67 |
18 ST (incluyendo TOC) y 12 CS |
7-17 |
Disminución de la conectividad entre el caudado y la región frontal dorsolateral (I). Gravedad del TOC asociada negativamente con el grado de conectividad del caudado (I) y corteza frontal dorsolateral; asociada positivamente con el giro subcalloso y con el núcleo lenticular. |
|
Thomalla et al.68 |
15 ST (solo tics, con medicación: 10) y 15 CS |
23-45 |
Aumento de la AF en la SB por debajo del giro post- y precentral, área motora suplementaria (I), parte posterolateral ventral del tálamo (D). Gravedad de los tics se correlaciona inversamente con la AF. |
|
Makki et al.47 |
23 ST y 35 CS |
5-17 |
Menor volumen caudado (I). Aumento de la difusión axial y difusión media en el putamen, aumento de la difusión radial en el tálamo (D), y una asimetría invertida de la AF en el tálamo. La gravedad del tic se correlaciona positivamente con la difusión radial del tálamo (D). |
ST: síndrome de Tourette; CS: controles sanos; TDAH: trastorno por déficit de atención e hiperactividad; TOC: trastorno obsesivo-compulsivo; YGTSS: The Yale Global Tic Severity Scale; SG/B: sustancia gris/blanca; I/D: izquierdo/derecho; AF: anisotropía fraccional; Y-BOCS: Yale-Brown Obsessive Compulsive Scales.
2.3 BASES NEUROFUNCIONALES DE LOS TICS
Como se indicó previamente, la hipótesis predominante en los últimos 20 años sobre el origen de los tics postula que ocurren por una desinhibición del estriado.32 De manera más específica, los tics estarían causado por una actividad anormal en las neuronas del estriado, provocando múltiples focos de inhibición en el globo pálido interno en diferentes partes y momentos. Por lo tanto, los movimientos voluntarios estarían facilitados de manera natural, aunque acompañado de una facilitación concomitante de otros patrones motores, dando lugar a movimientos no voluntarios. Si estos focos de activación perdurasen en el tiempo (de semanas a años), esto derivaría en el desarrollo de patrones de movimientos involuntarios estables y estereotipados (tics). No obstante, estudios recientes están poniendo en duda esta hipótesis.
Los estudios del cerebro en estado de reposo han permitido monitorizar los patrones de activación funcional relacionados con la generación de los tics. Estos estudios han identificado una activación significativa 2 segundos antes de la ocurrencia del tic en el área motora suplementaria, en el córtex sensitivo-motor y en la corteza parietal. Estos estudios también identifican una activación putaminal y talámica un segundo antes del tic y durante el tic.69 Estos estudios sugieren una activación cortical previa a la actividad en los ganglios basales (alteración en el control top-down), lo que cuestionaría la “hipótesis de la desinhibición” en la génesis de los tics.32 En apoyo de la hipótesis que postula una alteración en control cortical (top-down) de las vías motoras, un estudio de Wang y cols,70 usando conectividad efectiva (casualidad de Granger), muestra una disminución del control del córtex cingulado anterior sobre el núcleo caudado en pacientes con tics, lo cual se correlacionó con la gravedad de los tics. Se cree que la conectividad entre estas dos regiones es responsable, principalmente, del control cognitivo efectivo de la conducta motora.71
En apoyo a la hipótesis de la hiperexcitabilidad de los circuitos CEPTC como origen del tic, los estudios con estimulación magnética transcraneal han demostrado de manera consistente una disminución del control inhibitorio de estos circuitos en el ST. Evidencia de ellos es el descenso de las medidas de inhibición intracortical y el acortamiento del periodo de silencio cortical, en presencia de umbrales motores normales.72,73 En un amplio rango de edad, el grado de reducción de la inhibición intracortical parece correlacionarse con la gravedad del tic.74
Los fenómenos de reorganización adaptativa de distintas regiones corticales han ocupado buena parte de los estudios más recientes. Una de las concepciones predominante es la que entiende que en el ST ocurren distintos procesos dinámicos adaptativos que explicarían los cambios fenomenológicos observados especialmente durante la adolescencia y temprana adultez. Reflejo de estos procesos dinámicos podrían ser ciertas características de ocurrencia de los síntomas (wax and wane), la organización somatotópica de ciertos tics, o los procesos subyacentes para su control. Otro ejemplo de ello podría ser las diferencias en las bases estructurales y funcionales existentes entre los tics simples y los complejos. Como se apuntó en el apartado anterior, comparados con los tics simples, los tics complejos se asocian a alteraciones estructurales más extensas en regiones corticales asociativas, especialmente en regiones frontales y parietales.
Los estudios con neuroimagen funcional han mostrado una reducción de la activación del área motora primaria durante tareas de aprendizaje instrumental,75 o tareas de tipo Go-NoGo.76 Esta observación estaría relacionada con una reorganización adaptativa de los circuitos sensorio-motores, posiblemente en respuesta a una sobreactividad basal de estos circuitos generada por la presencia de tics.77 Algunos estudios han proporcionado explicaciones alternativas a estos cambios funcionales, tales como la presencia de alteraciones secundarias a la medicación psicotrópica, a polimorfismos asociados al género, o a cambios neurocompensatorios mantenidos en el tiempo. No obstante, los mecanismos subyacentes a estos cambios son hoy en día ampliamente desconocidos.78,79
Recientemente se ha sugerido que el mecanismo neurobiológico subyacente a la aparición de los tics estaría relacionado con un desarrollo atípico de ciertas regiones cerebrales. En pacientes pediátricos con ST, se han encontrado un patrón anormal de conectividad funcional en los circuitos fronto-parietales relacionados con el control cognitivo adaptativo. Este patrón se ha visto modulado por el grado de maduración en determinadas áreas específicas de estos circuitos.80,81 Patrones similares de conectividad estructural y funcional “inmaduros” en los circuitos cortico-basales se han observado en pacientes adultos,79,82,83 lo que sugiere que una desviación en la maduración cerebral podría ser uno de los factores clave relacionados con la persistencia del tic en la edad adulta.
Numerosos neurotransmisores (dopamina, glutamato, GABA, serotonina, acetilcolina, norepinefrina y opiáceos) están involucrados en la transmisión neuronal en los circuitos CEPTC, y a todos ellos se les ha atribuido un papel fisiopatológico en el origen del tic36. La disfunción dopaminérgica se considera la anormalidad principal en ST basada en la supresión de tics con el uso de antagonistas de la dopamina (antipsicóticos), tal y como se ha observado en distintos estudios de neuroimagen molecular,84-90 análisis del líquido cefalorraquídeo,91 y estudios postmortem.92-95 Se ha postulado que una hiperactividad del transportador de dopamina o una anomalía central conduce a una alteración en la liberación fásica de la dopamina, que a su vez da como resultado un sistema dopaminérgico dependiente de picos hiperreactivos.86,96 Esta hipótesis sobre una alteración del balance tónico-fásico dopaminérgico podría involucrar la corteza o el estriado. Aunque la mayoría de los estudios relacionados con neurotransmisores se han centrado en el estriado, existe abundantes hallazgos que apoyan una disfunción dopaminérgica extraestriatal, provenientes de estudios de tomografía emisión de positrones (PET), que muestran una disminución de receptores corticales y una mayor liberación de dopamina,97 así como anomalías dopaminérgicas corticales identificadas post mortem.94,95
Dado la diversidad fenotípica presente en ST, es muy probable que este trastorno implique una disfunción de más de un sistema de neurotransmisores o alteraciones del segundo mensajero.98 Se ha sugerido un efecto modulador alterado de la serotonina en ST por la combinación de, por un lado, niveles disminuidos del transportador de serotonina y, por otro, una elevación del receptor de serotonina 2ª,86 así como estudios de PET que identifican anomalías del metabolismo del triptófano en regiones corticales y subcorticales.86,99,100 El glutamato también tiene un papel esencial en los circuitos CEPTC y una amplia interacción con los sistemas dopaminérgicos. Hay líneas de evidencia que respaldan un posible papel del sistema glutamatérgico en ST, como son los provenientes de los resultados de estudios genéticos familiares,101-103 y niveles reducidos de glutamato en GPi, GPe y sustancia negra pars reticulata en estudios neuropatológicos.104 La neurotransmisión colinérgica alterada también se ha implicado por el hallazgo postmortem de un número reducido de interneuronas colinérgicas en el estriado de pacientes con ST.105 Aunque existe poca evidencia directa, se ha propuesto que una alteración de las proyecciones GABAérgicas del estriado o un deterioro de la inhibición cortical podría ser causa del ST. Por último, dado que múltiples neurotransmisores interactúan con adenosina 3 ', 5'-monofosfato (AMPc), un defecto post-receptor podría explicar una implicación en múltiples sistemas transmisores. En un pequeño número de muestras cerebrales postmortem, la cantidad de AMPc se encontraba reducida en varias regiones cerebrales.92 Sin embargo, estudios posteriores no mostraron anormalidades en la generación de segundo mensajero fosfatidilinositol.93 En resumen, se requieren más investigaciones para identificar el defecto bioquímico subyacente en este trastorno tan complejo.
2.4 BASES NEUROANATÓMICAS Y FUNCIONALES DE LAS SENSACIONES PREMONITORIAS
Las sensaciones o urgencias premonitorias han recibido una gran atención en la investigación de las bases neuroanatómicas y neurofisiológicas del ST. Esto se debe al hecho de que la presencia de estas sensaciones podría ser indicativa de aspectos cruciales para la caracterización fenotípica y pronóstico del síndrome, ya que se encuentran estrechamente relacionadas con la gravedad de los tics y la capacidad potencial de su control.106
Las urgencias premonitorias son sensaciones corporales que preceden a los tics. Los tics son considerados respuestas que sirven para reducir la intensidad de estas urgencias107. Las causas de estas sensaciones corporales están aún por determinar. Distintos estudios han señalado, de nuevo, la existencia de alteraciones dentro de los circuitos sensitivo-motores cortico-basales como posibles factores clave en la génesis de estas sensaciones. Algunas áreas señaladas como responsables de las sensaciones premonitorias como el área motora suplementaria,51,108 o la corteza somatosensorial,70,109 coinciden aquellas relacionadas los fenómenos sensoriales asociados al TOC. La estimulación eléctrica de estas regiones provoca sensaciones subjetivas de “necesidad de movimiento”.110
También se han descritos alteraciones de la sustancia blanca asociada a las sensaciones premonitorias. Por ejemplo, existe una correlación negativa entre la ocurrencia de estas sensaciones y la integridad del fascículo longitudinal superior,109 el cual se ocupa de la regulación de la conducta motora, la integración de la atención espacial con la acción, y la integración de la función somatosensorial.111
Estos hallazgos sugieren que en el origen de las sensaciones premonitorias puedan estar involucradas regiones fuera del circuito sensitivo-motor. De hecho, algunos estudios que usan modelos naturales de urgencias motoras, tales como el parpadeo o el picor, muestran actividad neuronal en regiones amplias, que incluyen la ínsula, la corteza prefrontal ventrolateral derecha, el córtex cingulado medial, las cortezas temporo-parietales bilaterales, estriado, y tálamo, asociada a estas conductas.112,113
Una teoría vigente en el campo sugiere que las sensaciones premonitorias se originan en regiones fuera de los circuitos sensitivos-motores. Basándose en los estudios de neuroimagen existentes sobre sensaciones que instan a acciones para aliviarlas, se ha propuesto un modelo que señala a la ínsula anterior como región encargada de la activación de las necesidades de aliviar la sensación, la corteza cingulada anterior participaría en la selección de la conducta adecuada para aliviar la sensación, mientras que la región más medial de la ínsula se encargaría de evaluar si las consecuencias de la acción y la generación del sentimiento de alivio.114 Algunos estudios sobre las urgencias premonitorias en pacientes con ST crónico parecen apoyar a este modelo. Ganos y cols.115 ha mostrado que la presencia de estas urgencias premonitorias está asociadas a una amplificación temporal de la toma de conciencia interoceptiva, probablemente por un aumento en la actividad de la ínsula anterior. En la línea de estos resultados, la región dorsal anterior de la ínsula muestra una elevada conectividad funcional con las regiones fronto-estriatales en pacientes con ST y se correlaciona positivamente con la escala PUTS, la cual mide la gravedad de las sensaciones premonitorias.116
2.5 BASES NEUROANATÓMICAS Y FUNCIONALES DE LA INHIBICIÓN DE LOS TICS
Una de las características definitoria de los tics es que se pueden reprimir, al menos parcial y temporalmente.117 La capacidad para la inhibición de los tics en ST parece regirse por mecanismos neuro-compensatorios que surgen de manera espontánea durante el desarrollo infantil y adolescente. La falta de estos mecanismos podría ser indicativo de un ST grave y la persistencia de los tics en la etapa adulta.118
La inhibición de los tics es un proceso activo (voluntario) que se activaría cuando se les pide a los pacientes que repriman los tics. Esto se ha asociado a la capacidad de una toma de consciencia temprana de las acciones voluntarias en pacientes con ST.119 La voluntariedad de estas acciones y la su toma de consciencia es, de hecho, la base de las terapias cognitivo-conductuales para el ST (p. ej. CBIT). No obstante, el control cognitivo sobre los tics puede también darse de manera inconsciente, por ejemplo, cuando los pacientes se encuentran realizando tareas que requieran atención focalizada (p. ej. en la escuela). Otra característica de la inhibición de los tics es que parece ser selectiva más que global; los tics presentan una distribución somatotópica, demostrando ciertas partes del cuerpo ser más propensas a mostrar tics. La capacidad de inhibición de los tics muestra un gradiente similar, siendo más probable la capacidad de inhibición de aquellas zonas del cuerpo donde los tics menos frecuentes.120
Los mecanismos neurales responsables de la inhibición de los tics son poco conocidos. Los estudios existentes hasta la fecha que exploran los circuitos cerebrales relacionados con el control del tic han descrito una sobre-especialización, tanto funcional como anatómica, de ciertas regiones cerebrales tradicionalmente involucradas en la inhibición y control de la conducta. Así, en pacientes con ST no grave se observa una potenciación de la conectividad funcional entre el área motora suplementaria y M1, de manera que disminuye el tic a través del aumento de la inhibición GABAérgica tónica sobre M1.121 Además, esta alteración en la conectividad se relaciona con una mejora en el desempeño en tareas de control conductual. Estos datos sugieren que los pacientes con ST que llegan a controlar el tic desarrollan mecanismos neuronales compensatorios durante el desarrollo del individuo, potenciando áreas cerebrales no incluidas en el CEPTC que actúan sobre el mismo circuito inhibiéndolo. Por otro lado, los mecanismos de neuroplasticidad compensatorios no sólo suponen un incremento de la conectividad funcional entre diferentes áreas, sino que también suponen cambios neuroanatómicos tal y como se ha observado en diversos estudios que muestran un aumento del volumen en la corteza prefrontal,62 la corteza cingulada,122 la amígdala y el hipocampo59. Este fenómeno se ha interpretado como una red de adaptación neural a la presencia de tics, cuyos mecanismos compensatorios ayudarían a suprimir o modular la gravedad de los tic.78
Otra región de la corteza prefrontal, el giro frontal inferior, también se ha involucrado en la inhibición de los tics. Como se mencionó en apartados anteriores, los pacientes con ST muestran una reducción de volumen de sustancia gris en el giro frontal inferior izquierdo comparado con controles.123 La implicación de esta área en el control de los tics también ha recibido apoyo de estudios con resonancia magnética funcional, que muestran un incremento de la actividad durante la inhibición de los tics que correlaciona con la habilidad de los pacientes para suprimir los tics.124 Los pacientes con buenos resultados tras terapia conductual para el control de los tics muestran una disminución significativa de la activación del estriado y del giro frontal inferior pre-tratamiento. Esta disminución se relaciona, a su vez, con los cambios en la gravedad de los tics.125
En resumen, la inhibición de tic es un proceso complejo y poco comprendido que implica, al menos dos sistemas: la actividad de rango amplio en circuitos cortico-estriatales, en combinación con un reordenamiento local (neuroquímicos y microestructurales).
2.6 LIMITACIONES Y RETOS
Las principales conclusiones de los estudios llevados a cabo hasta la fecha sobre las bases estructurales y funcionales del ST presentan limitaciones importantes que han tenerse en cuenta, y que podrían explicar las inconsistencias de algunos resultados. Parte de estas inconsistencias puede deberse a la gran heterogeneidad de las muestras estudiadas. Una gran parte de los estudios incluyen a muestras con un rango amplio de edad, incluso combinando datos provenientes de infantes, adolescentes y adultos. Como se ha podido observar en algunos estudios que controlan el factor edad, esta variable ejerce un papel fundamental en la explicación de algunos hallazgos neuroanatómicos y neurofisiológicos, por lo que se concluye que el ST ha de entenderse como un trastorno del neurodesarrollo que evoluciona con la edad. Por lo tanto, se necesitan más estudios con muestras de edades más restrictivas, de mayor tamaño, e incluso con diseños longitudinales capaces de captar las peculiaridades neuroanatómicas y neurofisiológicas asociadas a distintas etapas del desarrollo del paciente con ST.
También existen limitaciones importantes asociadas a los estudios en adultos con ST. Según algunos estudios epidemiológicos, en la edad adulta los tics sueles reducirse en un 50% de los casos y desaparecen en un 40% de los pacientes. Esta observación ha llevado al planteamiento de que la persistencia del ST en la edad adulta es un desenlace atípico, lo que complica la interpretación de multitud de estudios en adultos con ST. Sin embargo, la mayoría de estos estudios epidemiológicos se basan en medidas subjetivas, poco fiables. Algunos estudios que combinan medidas subjetivas con registros en vídeos han mostrado que el 90% de los adultos con ST en la infancia presentan tics. Por tanto, no está claro aún si el ST en la etapa adulta representa a los casos más graves, a los pacientes con mayor capacidad de introspección, o simplemente el curso típico del síndrome. Son necesarios, pues, estudios de neuroimagen y neurofisiológicos que comparen adultos con ST activo con adultos que presentaron ST durante la infancia cuyos síntomas remitieron o hayan mejorado significativamente en la etapa adulta. Desconocemos la existencia de estudios que incluyan este diseño hasta la fecha.
Otra importante limitación en muchos de los estudios revisados en este capítulo es la alta tasa de comorbilidades presente en los pacientes con ST. Se conoce que el TDAH está presente en hasta un 50% de los individuos con ST, y el TOC se da entre un 20% y un 60% de los mismos. Asimismo, se conoce que ambas comorbilidades presentan alteraciones neurobiológicas específicas y solapadas con las descritas en los ST sin comorbilidades. Además, existe otro problema de representatividad de la muestra si se estudia exclusivamente al subgrupo de individuos de ST puros ya que sólo representarían aproximadamente el 10% de todos los casos. Por lo tanto, son necesarios estudios con grandes muestras que incluyan subgrupos (p. ej. ST puro, ST+TDAH, ST+TOC, TDAH puro, TOC puro) de cara a entender la contribución en los hallazgos descritos de cada uno de estos trastornos por separado y combinados.
Otra posible fuente de confusión puede derivarse de los efectos de la medicación psicoactiva. Muchos de los pacientes incluidos en los estudios citados tomaban este tipo de medicación, bien en el momento del estudio, bien en el pasado, para tratar los tics y las comorbilidades comunes. Los fármacos más comunes son neurolépticos, antidepresivos, y estimulantes, entre otros, que afectan de manera significativa a la estructura y función cerebral. Por lo tanto, la inclusión de pacientes que no hayan tomado estos tratamientos representa la situación ideal de cara a llevar a cabo estos estudios. No obstante, al igual que el caso anterior, esto puede introducir distintos sesgos en el reclutamiento de la muestra, ya que estos pacientes suelen representar a aquellos casos menos graves. Desde un punto de vista práctico, reclutar a pacientes que nunca se han tratado puede ser una tarea ardua, lo cual puede reducir considerablemente los tamaños de las muestras de estudio. Algunos estudios hasta la fecha han intentado controlar por esta variable, bien incluyendo a un subgrupo de pacientes libres de medicación, bien incluyendo la medicación como covariable en los distintos análisis. En este aspecto, el uso de revisiones sistemáticas con metanálisis podrían ayudar a esclarecer el papel de los fármacos psicoactivos en las diferencias estructurales y funcionales señaladas.
Desde un punto de vista técnico, que afecta fundamentalmente a los estudios con RM, resulta complicado llevar a cabos ciertas adquisiciones en pacientes con excesivos movimientos en la cabeza. Este tipo de movimiento suele provocar artefactos ya que el cerebro cambia de localización en el espacio. Esta susceptibilidad al movimiento en pacientes con ST cuando se someten a este tipo de técnica es especialmente compleja de controlar en niños. Algunos estudios han intentado minimizar este aspecto reclutando a pacientes que no presentaban tics en la cabeza o bien usando complicados algoritmos para la corrección de estos movimientos.
3 - TRATAMIENTO DE LOS TICS
Lucía Triguero Cueva1, Adolfo Mínguez Castellanos1,2
1.Servicio de Neurología, Hospital Universitario Virgen de las Nieves, Granada
2.Instituto de Investigación Biosanitaria Ibs.GRANADA, Granada
3.1 INTRODUCCIÓN
Son numerosas las terapias que históricamente se han desarrollado para el tratamiento de los tics en el ST. Sin embargo, las evidencias actuales basadas en ensayos clínicos rigurosos siguen siendo limitadas. La propia naturaleza de la enfermedad, heterogénea y con fluctuaciones temporales, complica la interpretación de los estudios con pequeño tamaño muestral o seguimiento reducido. La coexistencia de trastornos conductuales, con influencia variable en los resultados, supone otro factor de confusión. Tampoco los objetivos terapéuticos y las medidas de respuesta más idóneas han sido ampliamente consensuadas. Estas dificultades condicionan que las recomendaciones de las principales revisiones sistemáticas y Guías de Práctica Clínica (GPC) 126-135 estén en parte basadas en evidencias de menor calidad metodológica, como la opinión de expertos.
Existe consenso en que la educación sanitaria al paciente y sus allegados debe constituir el primer escalón en el abordaje del ST.129,131,133,134 Una información adecuada y el apoyo profesional durante el seguimiento se consideran esenciales en el proceso de adaptación a la enfermedad. Es importante abordar los aspectos psicológicos, desarrollando estrategias que reduzcan la ansiedad y mejoren la tolerancia a la enfermedad a medio-largo plazo. Por si misma, esta medida puede ser suficiente para algunos pacientes, o al menos durante algunos periodos de tiempo.131
Sin embargo, cuando el ST repercute de forma significativa en la calidad de vida, incluyendo también aspectos funcionales y sociales (adaptación al entorno, rendimiento académico o laboral…), es necesario considerar otras terapias.128,131 Se debe establecer en qué medida la afectación de la calidad de vida está en relación directa con los tics o bien con otros trastornos conductuales o emocionales asociados. Los más prevalentes son el trastorno por déficit de atención con hiperactividad (TDAH) y el trastorno obsesivo-compulsivo (TOC) que, en caso de dominar el cuadro clínico, podrían requerir tratamiento en primera instancia.128,134
Para el tratamiento específico de los tics contamos con diferentes opciones, que se expondrán a continuación:
- Tratamiento farmacológico.
- Tratamiento conductual.
- Estimulación magnética transcraneal.
- Tratamiento neuroquirúrgico.
Los dos primeros grupos constituyen tratamientos bien establecidos, mientras que los dos últimos se consideran procedimientos aún en investigación.130,133,134 Se debe resaltar que todos ellos son tratamientos sintomáticos, sin evidencia de que modifiquen favorablemente el curso de la enfermedad; por otro lado se asocian, en mayor o menor medida, con inconvenientes y posibles efectos adversos. Debido a ello, se han propuesto criterios para establecer su indicación considerando el balance beneficio-riesgo (Tabla 3.1).128,131
| Tabla 3.1 Indicación para tratamiento específico de los tics en el ST |
|---|
|
Cuando esté presente cualquiera de las siguientes circunstancias en relación directa con los tics: |
|
· Malestar importante o dolor |
|
· Problemas emocionales significativos (ansiedad, depresión, baja autoestima…) |
|
· Interferencia funcional (actividades cotidianas, rendimiento académico o laboral…) |
|
· Estigma social (aislamiento, acoso…) |
Es importante informar a los pacientes y familiares de que el objetivo no será eliminar por completo los tics, sino reducirlos lo suficiente para minimizar su impacto negativo en la calidad de vida.128 La historia natural del ST, con fluctuaciones clínicas y tendencia a la mejoría en la etapa adulta, exige que cualquier tratamiento deba ser monitorizado, valorando su continuidad de forma periódica.132
3.2 TRATAMIENTO FARMACOLÓGICO
La disregulación del sistema dopaminérgico se considera la principal disfunción neuroquímica en el ST; de hecho, el primer y principal grupo farmacológico empleado en el tratamiento de los tics fue el de los antipsicóticos o neurolépticos, cuyo mecanismo fundamental es el bloqueo de los receptores D2 postsinápticos. No obstante, en la fisiopatología del ST están también implicados otros sistemas como el serotoninérgico, noradrenérgico, glutamatérgico, GABAérgico, colinérgico y opioide, con probables interacciones entre ellos.128
A continuación, se exponen los principales fármacos empleados para el tratamiento específico de los tics. Las conclusiones sobre su eficacia y seguridad se expresan de forma sintética atendiendo fundamentalmente a la evidencia derivada de ensayos clínicos controlados “doble-ciego” con asignación aleatoria, en los que han sido comparados con placebo y/u otros fármacos activos. En la Tabla 2 se presentan las dosis más comúnmente utilizadas; para una información más completa y precisa se recomienda consultar la ficha técnica de cada medicamento.
|
Tabla 3.2. Principales fármacos utilizados para el tratamiento específico de los tics en el ST | ||||||
|---|---|---|---|---|---|---|
|
GRUPO |
FÁRMACO |
DOSIS DE INICIO |
DOSIS DE MANTENIMIENTO |
EFICACIA (Nivel de evidencia) (1) |
PERFIL DE SEGURIDAD (2) |
PREFERENCIA (3) |
|
Agentes antipsicóticos |
HALOPERIDOL |
0.5 mg/día |
Niños: 0.5-3 mg/día Adultos: 1-15 mg/día |
A |
3 |
3ª línea |
|
PIMOZIDA |
0.5-1 mg/día |
Niños: 1-4 mg/día Adultos: 1-6 mg/día |
A |
2 |
2ª línea |
|
|
FLUFENAZINA |
0.5-1 mg/día |
Niños: 0.25-3 mg/día Adultos: 2.5-10 mg/día |
B |
2 |
3ª línea |
|
|
TIAPRIDA |
50-100 mg/día (2mg/Kg/día) |
2-10 mg/kg/día |
B |
1 |
2ª línea |
|
|
SULPIRIDA |
50-100 mg/día (2mg/Kg/día) |
2-10 mg/kg/día |
B |
1 |
2ª línea |
|
|
RISPERIDONA |
0.25 mg/día |
Niños: 0.25-3 mg/día Adultos: 0.25-6 mg/día |
A |
1 |
1ª línea: especialmente si coexiste TOC |
|
|
OLANZAPINA |
2.5-5.0 mg/día |
Niños: 2.5-10 mg/día Adultos: 2.5-20 mg/día |
B |
1 |
2ª línea |
|
|
QUETIAPINA |
50 mg/día |
Adultos: 300-450 mg/día |
C |
1 |
3ª línea |
|
|
ZIPRASIDONA |
5-10 mg/día |
Niños: 5-20 mg/día Adultos: 10-80 mg/día |
B |
1 |
2ª línea |
|
|
ARIPIPRAZOL |
2.5 mg/día |
Niños: 2.5-15 mg/día Adultos: 2.5-30 mg/día |
A |
1 |
1ª línea |
|
|
Agentes adrenérgicos |
CLONIDINA |
0.025 mg/día |
Niños: 0.025-0.3 mg/día Adultos: 0.1-0.6 mg/día |
A |
1 |
1ª línea: especialmente si coexiste TDAH |
|
GUANFACINA |
0.5 mg/día |
Niños: 0.5-3 mg/día Adultos: 1-4 mg/día |
B |
1 |
2ª línea: especialmente si coexiste TDAH |
|
|
ATOMOXETINA |
≤ 70 Kg: 0.5 mg/Kg/día > 70 Kg: 40 mg/día |
≤ 70 Kg:1.2 mg/Kg/día > 70 Kg: 80 mg/día (máx. 100 mg/día) |
B |
1 |
2ª línea: exclusivamente si coexiste TDAH |
|
|
Otros fármacos |
TOPIRAMATO |
25 mg/día |
Niños: 1-9 mg/kg/día Adultos: 50-200 mg/día |
B |
2 |
3ª línea |
|
TETRABENAZINA |
12.5 mg/día |
Niños 12.5-50 mg/día Adultos: 12.5-100 mg/día |
C |
2 |
3ª línea |
|
|
CLONAZEPAM |
0.25-0.5 mg/día |
> 10 años: 3-6 mg/día |
C |
2 |
3ª línea |
|
|
TOXINA BOTULÍNICA |
Variable |
Variable |
C |
2 |
Exclusivamente en determinados tics localizados |
|
(1) Eficacia (nivel de evidencia): A = basado en al menos 2 ensayos clínicos controlados “doble-ciego” con asignación aleatoria y resultados concordantes; B= basado en 1 ensayo clínico controlado “doble-ciego” con asignación aleatoria, o en 2 o más con resultados discordantes; C= basado en ensayos no controlados y series de casos.
(2) Perfil de seguridad (riesgo de efectos adversos significativos): 1 = riesgo bajo; 2 = riesgo medio; 3 = riesgo elevado.
(3) Preferencia terapéutica orientativa: 1ª línea = nivel de evidencia A y riesgo bajo; 2ª línea = nivel de evidencia A y riesgo medio, o nivel de evidencia B y riesgo bajo; 3ª línea = nivel de evidencia A y riesgo elevado, o nivel de evidencia B y riesgo medio/ elevado, o bien nivel de evidencia C con cualquier perfil de seguridad.
Abreviaturas: ST = síndrome de Tourette; TDAH = trastorno por déficit de atención con hiperactividad; TOC= trastorno obsesivo-compulsivo.
3.2.1. Agentes antipsicóticos.
Su eficacia en el tratamiento de los tics fue establecida hace más de 40 años y está relacionada con el bloqueo de los receptores dopaminérgicos D2 a nivel estriatal. Sus efectos adversos (más frecuentes con los denominados “típicos”), incluyen principalmente: sedación, aumento de peso, prolongación del intervalo QT en el electrocardiograma (ECG), trastornos metabólicos (aumento de glucosa, lípidos, prolactina) y aparición de otros trastornos del movimiento (parkinsonismo, temblor, acatisia, distonía, discinesias tardías).136 Se debe contemplar asimismo el riesgo de síndrome neuroléptico maligno. Su uso requiere por tanto monitorización clínica, incluyendo control del peso, analítica y ECG.128,132
3.2.1.1. Antipsicóticos de primera generación (“típicos”).
- Haloperidol. Fue el primer tratamiento (y el único en España) con indicación aprobada para el ST. Aunque su eficacia a corto plazo ha sido demostrada en ensayos clínicos controlados, asocia frecuentes efectos adversos, por lo que su uso actual se limita a casos graves en los que no han sido útiles otros tratamientos con mejor perfil.128,132,136
- Pimozida. Varios ensayos clínicos controlados confirman su eficacia, que no difiere en gran medida de la de haloperidol, aunque con menor frecuencia de efectos adversos.128,132,136
- Flufenazina. También ha sido muy utilizada para el tratamiento de los tics, principalmente en EEUU. Un ensayo clínico controlado mostró una eficacia similar a haloperidol, con menor frecuencia de efectos adversos.128,132,136
3.2.1.2. Benzamidas.
- Tiaprida y sulpirida. Bloqueantes D2 con especial selectividad sobre el sistema límbico. Aunque son antipsicóticos de primera generación, estarían en realidad más cercanos a los denominados “atípicos” en cuanto a su mejor perfil de efectos adversos. Estudios controlados con uno y otro fármaco han demostrado eficacia sobre los tics128,136. Sus principales efectos adversos son sedación, hiperprolactinemia y aumento de peso136. No están disponibles en determinados países, como EEUU y Canadá; sin embargo, en Alemania han sido considerados de primera línea128.
3.2.1.3. Antipsicóticos de segunda generación (“atípicos”).
Ejercen en general un menor grado de bloqueo dopaminérgico, pero mayor serotoninérgico, así como también bloquean receptores de noradrenalina (α1) e histamina (H1). En cuanto a efectos adversos, la principal diferencia respecto a los “típicos” es su menor incidencia de trastornos del movimiento e hiperprolactinemia. No están libres, sin embargo, de cualquiera de los efectos adversos mencionados para el grupo de los antipsicóticos, especialmente a altas dosis, y pueden asociar otros adicionales (hipotensión ortostática, taquicardia, síntomas anticolinérgicos, etc).136
- Risperidona. Es el fármaco de este grupo mejor estudiado para el tratamiento del ST. Varios ensayos clínicos controlados avalan su eficacia a corto plazo sobre los tics, que sería similar o algo superior a pimozida y similar a clonidina.128,132,134 Sin embargo, el beneficio global es claramente superior en pacientes que asocian TOC o conductas agresivas, dada su eficacia adicional sobre estas condiciones comórbidas.128 Respecto a sus efectos adversos, destacar especialmente la mayor frecuencia de hiperprolactinemia respecto a otros fármacos de su grupo.136,137
- Olanzapina. Ha demostrado eficacia en el control de los tics superior a pimozida, con mejor perfil de efectos adversos.128,132,134,136 Asocia mayor frecuencia de aumento de peso que otros fármacos de su grupo.136
- Quetiapina. Su eficacia sobre los tics deriva de estudios abiertos; no obstante destaca su buen perfil de seguridad, con menor incidencia de trastornos del movimiento e hiperprolactinemia.128,132,136
- Ziprasidona. Un estudio controlado ha mostrado eficacia frente a placebo en niños y adolescentes; parece tener menor incidencia de aumento de peso respecto a otros fármacos de su grupo.128,132,134,136
- Aripiprazol. Al contrario que otros antipsicóticos atípicos, actúa como agonista parcial D2 y 5TH1A, así como antagonista 5HT2A. Dos ensayos recientes en niños y adolescentes, con amplio tamaño muestral, han confirmado su eficacia frente a placebo, con buen perfil de seguridad.138,139 Sus efectos secundarios más frecuentes fueron sedación, somnolencia y fatiga.139
3.2.2. Agentes adrenérgicos.
3.2.2.1 Agonistas adrenérgicos α-2.
- Clonidina. Se trata de un fármaco eficaz para el TDAH, que también ha sido utilizado desde antiguo en el ST, más en Norteamérica que en Europa. Respecto al control de los tics, los ensayos clínicos controlados han mostrado resultados variables, aunque los más recientes y con mayor tamaño muestral confirman su eficacia en niños y adolescentes.128,132,134 La reducción de los tics fue, en un estudio, similar a risperidona.140 Sus efectos adversos más comunes son sedación al inicio, boca seca, cefalea, irritabilidad e insomnio; también puede inducir hipotensión ortostática y bradicardia.136 Se recomienda monitorizar la tensión arterial y el pulso; algunas GPC aconsejan también controles mediante ECG.128 Su indicación oficial en España se limita al tratamiento de la hipertensión arterial.
- Guanfacina. Se considera una alternativa a clonidina con menos efectos adversos, aunque los resultados de los estudios controlados respecto al control de los tics han sido contradictorios.128,132,134 Su indicación oficial en España es el TDAH.
3.2.2.2. Inhibidores selectivos de la recaptación de noradrenalina.
- Atomoxetina. Ha demostrado eficacia para el TDAH en niños y está aprobado en España con esta indicación. En un estudio controlado también fue eficaz sobre los tics, si bien se trataba en su mayoría de niños o adolescentes con tics leves-moderados.141 No obstante, también se han descrito pacientes con exacerbación o recurrencia de los tics durante el tratamiento con atomoxetina.128 Sus efectos adversos más comunes son náuseas, pérdida de apetito y peso, y aumento de la frecuencia cardiaca.128
3.2.3. Otros fármacos.
- Topiramato. Anticomicial de amplio espectro con actividad GABAérgica y bloqueador de receptores AMPA/kainato. Un pequeño ensayo clínico controlado, que incluyó tanto niños como adultos, mostró beneficio significativo sobre los tics.142 Como efectos adversos es necesario considerar, entre otros, la posible aparición de trastornos cognitivos o anímicos, pérdida de peso, glaucoma o nefrolitiasis.132
- Tetrabenazina. Inhibidor del transportador vesicular de monoaminas tipo 2 (VMAT2) que reduce la dopamina y serotonina presinápticas y bloquea los receptores postsinápticos de dopamina. Existe amplia experiencia de uso en distintas hipercinesias, incluido los tics, si bien faltan estudios controlados.128,132,143 Sus principales efectos adversos son sedación, náuseas, insomnio, depresión, parkinsonismo y acatisia. Los VMAT2 de segunda generación (deutetrabenazina, valbenazina) podrían presentar un mejor perfil de efectos adversos.136,143
- Clonazepam. Benzodiacepina que actúa principalmente como agonista GABAérgico. Se ha venido utilizando desde hace años en el ST, aunque faltan estudios controlados. En estudios “simple-ciego” se ha objetivado igual o mayor eficacia que clonidina o haloperidol.128 Sus efectos adversos más comunes son sedación y dificultades cognitivas.136
- Toxina botulínica. Las inyecciones intramusculares de toxina botulínica se han utilizado en el tratamiento de determinados tics motores simples muy localizados (por ejemplo, en la cara o el cuello), al inducir debilidad temporal de los músculos implicados.128,132 También se ha probado en tics vocales, incluso en la coprolalia. Además de distintos estudios abiertos, se ha llevado a cabo un pequeño estudio cruzado controlado con placebo que demuestra una reducción significativa en la frecuencia del tic tratado, aunque sin acompañarse de beneficio global subjetivo.144 Una reciente revisión de la Colaboración Cochrane concluye que no hay suficiente evidencia para establecer su indicación en el ST.145
- Otros fármacos con evidencia negativa o insuficiente. Además de los fármacos mencionados, se han ensayado numerosos principios activos en el ST, algunos de ellos con resultados prometedores en estudios abiertos y pequeños estudios controlados. No obstante, la evidencia actual ha resultado ser negativa para algunos (levetiracetam) o bien se considera insuficiente para otros (metoclopramida, baclofeno, nicotina, tetrahidrocannabinol, naloxona, etc.).128,132
TRATAMIENTO FARMACOLÓGICO: CONCLUSIONES
Una vez decidido el inicio de un tratamiento farmacológico para los tics, es necesario establecer un orden de preferencia terapéutica. Para ello deben tenerse en cuenta las características individuales, fundamentalmente la edad y comorbilidad. En general se consideran como de primera elección los antipsicóticos risperidona y aripiprazol, así como, especialmente en niños o adolescentes con TDAH, los agonistas adrenérgicos α-2.128,132,134,135 Existen, sin embargo, ciertas discrepancias en las principales GPC, de tal forma que la Guía Europea da un mayor peso a los antipsicóticos (incluyendo también tiaprida y sulpirida),128 y la Guía Canadiense a los agonistas adrenérgicos α-2.132
En la tabla 2 se expone una propuesta de preferencia terapéutica basada en la combinación entre eficacia demostrada y perfil de seguridad. Según esta clasificación orientativa serían fármacos de primera línea: risperidona (especialmente si coexiste TOC), aripiprazol y clonidina (especialmente si coexiste TDAH); de segunda línea: pimozida, tiaprida, sulpirida, olanzapina, ziprasidona, guanfacina y atomoxetina (estos dos últimos si coexiste TDAH); y de tercera línea: haloperidol, flufenazina, quetiapina, topiramato, tetrabenazina y clonazepam. La toxina botulínica solo es planteable, como terapia única o añadida, para el tratamiento de determinados tics localizados. Es necesario señalar que la prescripción de todos los fármacos mencionados para el ST, a excepción de haloperidol, está sujeta en España a las condiciones establecidas para su uso “fuera de ficha técnica” (“off-label”).
Una vez seleccionado el primer fármaco a probar, se deben seguir las pautas habituales para cualquier tratamiento sintomático: ascenso escalonado, mantenimiento de la dosis mínima efectiva y seguimiento periódico, para monitorizar posibles efectos adversos y evaluar la necesidad de continuación128. En este sentido es común plantear en determinados momentos una reducción progresiva de la dosis.132 Existen escasas evidencias sobre la combinación de fármacos. Si un fármaco no ha sido efectivo tras varias semanas o pocos meses, lo habitual es retirarlo y seguir probando otros en monoterapia de forma consecutiva. Es posible en ocasiones encontrar un tratamiento efectivo tras varios intentos fallidos146.
3.3 TRATAMIENTO CONDUCTUAL
Desde hace décadas se han venido desarrollando diversas técnicas cognitivo-conductuales para el tratamiento de los tics, que han sido evaluadas tanto de forma individual, como combinadas en protocolos de intervención estandarizados.129,133-135
Las técnicas básicas de modificación de conducta más estudiadas son:
- Reversión del hábito: entrenamiento para contrarrestar el impulso que lleva a realizar el tic con una acción voluntaria que lo evite.
- Exposición con prevención de respuesta: entrenamiento para tolerar el impulso e inhibir el tic.
Entre los protocolos estandarizados más conocidos se encuentran la denominada “Intervención Conductual Exhaustiva para el Tratamiento de los Tics” (basada fundamentalmente en técnicas de reversión del hábito),147 y el “Manual Escandinavo” de reciente desarrollo (que incluye tanto técnicas de reversión del hábito como de exposición con prevención de respuesta).148
Se han llevado a cabo diversos estudios controlados para evaluar estas terapias en niños/adolescentes y adultos, con o sin medicación concomitante.147-151 Se aplican generalmente en sesiones individuales de 1-2 horas de duración, con frecuencia semanal, hasta completar en torno a 10 semanas. Las técnicas de reversión de hábito,147,149,151 al igual que las de exposición con prevención de respuesta,150 han demostrado eficacia para reducir la frecuencia e intensidad de los tics, tanto motores como vocales, que puede mantenerse durante al menos 10 meses tras completar un ciclo de sesiones.149 Como alternativa a las sesiones individuales, el Manual Escandinavo ha demostrado ser igualmente efectivo aplicado en sesiones grupales.148
La característica fundamental de estas terapias es su dependencia de profesionales altamente especializados, lo que limita su accesibilidad general. Por otro lado, requieren un alto grado de motivación y colaboración activa, por lo que no son adecuadas para determinados pacientes, como niños pequeños, o que asocien TDAH, dificultades de aprendizaje u otras comorbilidades133. En cualquier caso el paciente debe comprender y aceptar el tratamiento, cuyo beneficio dependerá en gran parte de su implicación personal y podrá ser más lento que el obtenido con fármacos.129,133
Las GPC recomiendan plantear las técnicas conductuales mencionadas como de primera línea, especialmente en niños mayores, adolescentes y adultos, siempre que tengan acceso y acepten esta opción.129,133-135 Tras 10 semanas de tratamiento, si la respuesta ha sido parcial, podría plantearse otro ciclo de 10 semanas.129 Si la respuesta fuera claramente insatisfactoria se recomienda probar un protocolo conductual diferente, o bien iniciar tratamiento farmacológico (manteniendo o no la terapia conductual)129. En los casos más graves se considera preferible comenzar pronto con tratamiento farmacológico, considerando entonces la terapia conductual como posible coadyuvante.129
3.4 ESTIMULACIÓN MAGNÉTICA TRANSCRANEAL
Ya en el campo de las terapias experimentales, se podría destacar especialmente este procedimiento no invasivo que emplea campos magnéticos extracraneales para modular la actividad eléctrica cortical. En el estudio de la fisiopatología del ST, distintos trabajos con esta técnica apoyan la existencia de una reducción del control inhibitorio sobre el córtex cerebral, que conduce a una hiperexcitabilidad cortical secundaria.152. Su aplicabilidad terapéutica se basa por tanto en la posibilidad de corregir, al menos temporalmente, esta disfunción cortical.
Se han publicado diversos estudios abiertos, tanto en niños como adultos, con resultados prometedores, sobre todo cuando se aplica sobre el área motora suplementaria frente a otras áreas, como el córtex motor o premotor.152. En estos estudios, obtuvieron mayor beneficio los pacientes más jóvenes y con comorbilidades asociadas (TDAH y/o TOC). Sin embargo, varios estudios controlados en pacientes adultos, incluido un ensayo “doble-ciego” con 20 pacientes asignados aleatoriamente a estimulación real o simulada (15 sesiones de 30 minutos sobre el área motora suplementaria a lo largo de 3 semanas),153 no han demostrado mejoría estadísticamente significativa sobre los tics. En cualquier caso, puesto que no se han detectado efectos secundarios significativos, al menos a corto plazo, se precisan nuevos estudios que investiguen más extensamente su potencialidad.133,134,152
4 - TRATAMIENTO QUIRÚRGICO DEL SÍNDROME DE TOURETTE
Beatriz De la Casa Fages; Francisco Grandas
Unidad de Trastornos del Movimiento-CSUR. Servicio de Neurología. Hospital General Universitario Gregorio Marañón. Madrid
4.1 INTRODUCCIÓN
Aunque la estimulación cerebral profunda (ECP) no está aprobada como tratamiento para el ST ni por la EMA ni la FDA, múltiples series de casos, registros internacionales y algunos ensayos clínicos han mostrado su eficacia en casos seleccionados refractarios al tratamiento médico.
En este capítulo realizamos una revisión bibliográfica sobre la terapia con ECP en ST, evidencia científica actual, perfil de paciente candidato, dianas terapéuticas y resultados.
4.1 MÉTODOS
Se realizó una búsqueda bibliográfica usando los términos “Tourette syndrome OR Tourette’s syndrome OR Gilles de la Tourette syndrome AND deep brain stimulation” en Pubmed. Se limitó la búsqueda a trabajos en inglés publicados en los últimos 10 años, seleccionando ensayos clínicos, series de casos y revisiones. Además se realizó una búsqueda de revisiones sistemáticas de la base Cochrane usando los mismos términos, sin encontrar resultados. En el Ministerio de Sanidad, Consumo y Bienestar Social encontramos dentro de los informes de evaluación de tecnologías sanitarias un resultado.154 No encontramos evidencia respecto a ECP en ST en las guías NICE pero sí en una guía europea.130 Se encontraron 103 artículos con estos criterios de búsqueda. La mayoría de los trabajos son series de casos no controlados, con un reducido número de pacientes tratados (casos aislados o menos de 5 pacientes). Se identificaron 8 ensayos clínicos,155-161 un estudio de cohorte internacional prospectivo,162 una revisión sistemática y meta-análisis,163 una revisión y actualización de la guía de la TSA (Tourette Syndrome Association) para la selección y evaluación de pacientes con ST para ECP,164 y el apartado IV (ECP) de la última guía europea para ST y otros trastornos con tics.130
4.2. PACIENTES TRATADOS
El primer caso de ST intervenido con ECP fue publicado en 1999, cuya diana fue el núcleo ventral intermedio (Vim) talámico.165 Desde entonces, aunque sigue siendo un número reducido de pacientes, en una revisión sistemática de 2016,163 se reportaron 156 pacientes con ECP para ST y el recientemente publicado Registro Internacional de ST y ECP,162 incluyó 185 pacientes entre enero de 2012 y diciembre de 2016.
4.3 MECANISMO DE ACCIÓN
Aunque a día de hoy el mecanismo de acción de la ECP no está claramente dilucidado, la disfunción de los circuitos córtico-estriato-pálido-tálamo-corticales que subyace como uno de los mecanismos fisiopatológicos en el ST es la base del potencial terapéutico de la ECP en dicha enfermedad,79 al modular la actividad anómala en dichos circuitos. Se ha demostrado, mediante resonancia funcional intraoperatoria, una modulación global del circuito mediante ECP talámica, incluyendo redes límbicas, motoras y frontoestriatales.166
4.4 CRITERIOS DE SELECCIÓN
Para indicar ECP a un paciente con ST inicialmente habrá que confirmar el diagnóstico en base a los criterios diagnósticos del DSM-V,167 por un médico experto en ST y con amplia experiencia clínica. El paciente deberá presentar tics severos (tanto vocales como motores) refractarios a diferentes líneas de tratamiento farmacológico y terapia conductual, siendo los tics la mayor causa de discapacidad. Según las recomendaciones de la TSA en 2015 (Tabla 1),164 la cirugía debería ser ofrecida en centros con amplia experiencia en ECP tras una evaluación exhaustiva del paciente por equipos multidisciplinares incluyendo la comorbilidad psiquiátrica del paciente.
A pesar de las consideraciones éticas que puede conllevar realizar una cirugía para un síndrome que potencialmente puede resolverse en la edad adulta en la mayoría de los pacientes18, también hay pacientes en edad pediátrica intervenidos en las series publicadas, ya que la edad no es criterio de exclusión. De hecho, en la revisión reciente de Smeets et al.,168 se encontraron 33 pacientes operados con menos de 25 años. En pacientes pediátricos la evaluación de la indicación debería ser aún más minuciosa y habría que considerar involucrar al comité ético de la institución correspondiente en la toma de decisión.
| TABLA 4.1 Criterios de selección de pacientes con síndrome de Tourette candidatos a Estimulación Cerebral Profunda. | |
|---|---|
|
DIAGNÓSTICO |
Criterios diagnósticos de ST DSM-V por experto clínico. No hay límite de edad * Cuando sean menores de 18 la decisión será tomada con el comité ético local correspondiente |
|
SEVERIDAD DE TICS |
Tics severos con impacto funcional Documentados con evaluación video estandarizada Los tics tienen que ser el motivo principal de discapacidad YGTSS > 35/50 |
|
COMORBILIDAD NEUROPSIQUIÁTRICA (TOC, ansiedad, depresión, TDAH) |
Deberán ser tratadas y evaluados formalmente con escalas validadas |
|
FRACASO DE TERAPIA CONVENCIONAL |
-Haber probado al menos 3 líneas de tratamiento: a) Alfa-agonistas adrenérgicos (clonidina) b) 2 antipsicóticos (típicos y atípicos) c) al menos otros fármaco de otro mecanismo de acción (clonazepam, tetrabenazina) -Haber ofrecido terapia cognitivo-conductual |
|
COMORBILIDAD MÉDICA, FACTORES PSICOSOCIALES |
Estable en los 6 meses previo a cirugía Buen apoyo social Cuidador disponible para acompañar al paciente para visitas frecuentes Descartar y evaluar presencia de tics psicogénicos, síntomas facticios o trastornos de personalidad No consumo actual o reciente de substancias de abuso No lesión/alteración estructural en RMN cerebral No procesos médicos o psiquiátricos concomitantes que aumenten el riesgo del procedimiento o interfieran en el postoperatorio |
|
IDEACIÓN SUICIDA/HOMICIDA |
Confirmar que no están presentes al menos en 6 meses |
Adaptado de Schrock et al, 2015.164
4.5 DIANAS QUIRÚRGICAS
Hasta ocho dianas se han utilizado en ECP en el ST. Las dianas más frecuentes fueron: región medial del tálamo (núcleo ventral intermedio; núcleo centromediano-complejo parafascicular) y globo pálido interno (región anteromedial o límbica y región posteroventral). También se han descrito algunos casos intervenidos en globo pálido externo, núcleo subtalámico ( el paciente padecía tics y enfermedad de Parkinson), la región del brazo anterior de cápsula interna/núcleo accumbens y campos de Forel (región H1 de Forel).169
La diana más empleada según la revisión y meta-análisis de 2016 es el tálamo (78 pacientes), seguida por GPi anteromedial (44 pacientes) y GPi posterolateral (20 pacientes). Estos datos coinciden con los del Registro Internacional: tálamo (94 pacientes), GPi anterior (50 pacientes), GPi posterior (34 pacientes), brazo anterior de cápsula interna-núcleo accumbens (8 pacientes).
Veinte pacientes fueron intervenidos en más de una diana (18 pacientes en 2 dianas, 2 pacientes con tres dianas quirúrgicas). En la mayoría de los casos la diana adicional fue empleada por escasa mejoría terapéutica con la inicial.
En la mayoría de los pacientes publicados se ha empleado una estimulación bilateral. En el Registro Internacional de pacientes con ST y ECP,162 sólo 3 pacientes presentaban estimulación unilateral.
Existen escasos estudios controlados que comparen la eficacia entre diferentes dianas quirúrgicas para ST. Houeto et al, publicaron el primer caso dentro de un estudio prospectivo doble ciego randomizado comparativo para evaluar la eficacia de estimulación de región centromediana-complejo parafascicular del tálamo, parte interna del GPi o ambas,155 mediante la implantación de 4 electrodos. La ECP de ambos núcleos de forma aislada o combinada mejoró la frecuencia y severidad de los tics, incluyendo las conductas autolesivas, en un 70% sin diferencias entre las dianas y sin un efecto sinérgico cuando se estimulaban conjuntamente. El mismo grupo publicó posteriormente la evolución de dicha paciente y dos más, confirmándose la mejoría importante de los tics evaluados mediante la escala YGTSS,170 con estimulación palidal (reducción de la severidad de los tics en un 65%, 96%, y 74% en cada paciente respectivamente). Con la estimulación en núcleo centromediano-complejo parafascicular talámico la reducción fue del 64%, 30%, y 40%; la combinación de estimulación palidal y talámica no indujo una reducción adicional de los tics, mientras que la estimulación placebo produjo una reemergencia de los tics.159
Martinez et al.,171 evaluaron en un estudio abierto la eficacia de la ECP anteromedial en 2 pacientes con ST respecto a región posteromedial del GPi. Un quinto paciente fue intervenido inicialmente en región posterior de GPi y posteriormente en región anteromedial. La intensidad de los tics fue evaluada pre y postcirugía mediante filmación según el protocolo modificado de Rush,172 y la YGTSS. Se observó una mayor reducción de los tics con ECP de la región anterior de GPi.
En un estudio realizado en 15 pacientes se correlacionó el volumen tisular activado en el GPi con la respuesta clínica a la ECP.173 Se observó que la zona que predecía una mejor respuesta en tics motores, vocales y puntuación en YGTSS era la zona límbica ventral del GPi, específicamente en lámina medular medial o interna del pálido al nivel de la unión de la comisura anterior y posterior.
4.6 PARÁMETROS DE ESTIMULACIÓN
La mayoría de los casos publicados presentan una gran variabilidad en los parámetros de estimulación, con configuraciones monopolares, bipolares o doble monopolares, una amplitud entre 1.3 y 7.3 V (no hay casos descritos con corriente continua); frecuencias entre 20 y 210Hz y ancho de pulso entre 60 y 210μs,163,171 En el meta-análisis no se encontró diferencias significativas entre los parámetros de estimulación y el resultado clínico. Por el contrario, se encontró diferencias entre las amplitudes empleadas según la diana, siendo significativamente mayores en la región de brazo anterior de cápsula interna/núcleo accumbens y GPi región anteromedial respecto al tálamo.
En base a los resultados de los estudios prospectivos, la optimización de los parámetros de estimulación en ST puede durar meses, aspecto que deberá ser tenido en cuenta en el diseño de futuros ensayos.174
Puesto que el ST tiene una manifestación paroxística, con episodios intermitentes de tics motores o vocales, además del componente psiquiátrico, se está investigando la opción de que en lugar de utilizar una estimulación continua con parámetros programados previamente (neuroestimuladores actualmente comercializados), se utilice una ECP adaptativa conocida también como sensible o “closed loop”, en la cual la estimulación se active en respuesta a los tics o las señales neurobiológicas que lo preceden, ya sean eléctricas o neuroquímicas..175 Recientemente se ha publicado el primer paciente con ST tratado con estimulación sensible,176 obteniendo una mejoría de los tics del 63,3 % (MRTRS) y 48% (YGTSS) al cabo de un año postcirugía, respuesta comparable a la estimulación crónica convencional con la ventaja del ahorro de batería. Marceglia et al,177 han publicado una serie de 7 pacientes con ST donde la ECP adaptativa a nivel talámico se basa en cambios de potenciales de campo locales, con resultados prometedores.
4.7 RESULTADOS DE EFICACIA
La mayoría de los estudios publicados de ECP en ST utilizan como medidas de eficacia la escala de tics de Yale (YGTSS), 170 y en segundo lugar la escala modificada mediante videofilmación de Rush (Modified Rush video-based rating scale).172 En este apartado solo se consideran los ensayos clínicos, meta-análisis y el registro prospectivo de pacientes.
4.7.1 Ensayos clínicos doble-ciego aleatorizados
4.7.1.1 ECP talámica
Maciunas et al,157 evaluaron a 5 pacientes con estimulación unilateral izquierda y derecha, bilateral y off estimulación durante 1 semana y posteriormente 3 meses en fase abierta. La estimulación bilateral ciega produjo una mejoría de los tics motores del 53% y fónicos del 70%. En fase abierta la reducción de los tics motores fue del 40% y los fónicos aumentaron un 71%.
Ackermans et al,161 estudiaron 6 pacientes de manera ciega con estimulación encendida o apagada durante 6 meses postcirugía (aleatoriamente 3 meses encendida y 3 meses apagada, estudio cruzado) seguido de 6 meses de estimulación en fase abierta. Solo 2 pacientes completaron la evaluación ciega. En la fase ciega la estimulación produjo una mejoría del 37% en la YGTSS comparado con off-estimulación, mientras que en la fase abierta esa mejoría aumentó a un 49%.
4.7.1.2. Estimulación del globo pálido interno
Kefalopoulou et al,156 evaluaron la eficacia de la estimulación de GPi anteromedial en 15 pacientes. Los resultados fueron bastante modestos, encontrando un beneficio escaso en la reducción de los tics en la fase ciega: mejoría media en la YGTSS de 12.4 puntos (95% CI 0.1–24.7, p=0.048), equivalente a una mejoría del 15.3%.
Welter et al,160 estudiaron 19 pacientes con ST tratados con ECP del GPi anterior. La evaluación doble ciego a 3 meses postcirugía no mostró disminución de la severidad de los tics, pero a 6 meses, en la fase abierta, sí se encontró mejoría significativa de los tics y una tendencia a la mejoría en las actividades de la vida diaria a los 11 meses post-cirugía.
Otro estudio evaluó 5 pacientes con estimulación de 2 dianas: GPi y tálamo centromediano bilateral.178 El objetivo principal de este estudio fue evaluar el efecto de la ECP en la perfusión cerebral mediante SPECT marcado con TC99. En este trabajo no se encontraron diferencias significativas entre ECP talámica, ECP del GPi y placebo.
4.7.2 Estudios no controlados
En el meta-análisis de 2016,163 se analizaron trabajos publicados entre 1999 y Marzo de 2015, resultando en 57 estudios y 156 pacientes. Se observó una reducción media del 53% en la YGTSS. No se encontraron diferencias entre las diversas dianas utilizadas (tálamo, región posteroventrolateral y anteromedial del GPi, brazo anterior de cápsula interna y núcleo accumbens). Se detectó una correlación negativa entre mayor puntuación en la YGTSS y mejoría tras estimulación talámica.
Los datos publicados recientemente del Registro Internacional de pacientes con ST y ECP sobre 171 pacientes evaluados, mostró una mejoría en la puntuación medial global de la YGTSS de 75.01 precirugía a 41.19 el primer año postcirugía (p < .001) (54,5 %). La subescala de tics motores mejoró de 21.00 a 12.91 (p< .001) (38.5) y los tics fónicos de 16.82 a 9.63 (p < .001) (42.7%) también en el primer año postcirugía. Se encontraron diferencias en la respuesta clínica entre las dianas quirúrgicas: GPi anterior obtuvo una mayor mejoría que tálamo y éste fue superior a GPi posterior.
4.8 EFECTOS ADVERSOS
En el Registro Internacional la tasa global de efectos adversos en relación con la estimulación fue del 35.4%, hemorragias intracraneales (1.3%), infección en (3.2%), retirada de electrodos (0.6%). Los efectos adversos más frecuentes inducidos por la estimulación fueron disartria (6.3%) y parestesias (8.2).
La tasa de infecciones en pacientes con ST según diferentes trabajos es superior a la de pacientes con otros trastornos del movimiento que se someten a cirugía de ECP. Esta proporción es del 13-20% tanto para estimulación talámica como palidal, mientras que la ECP del GPi para distonia o enfermedad de Parkinson está entre el 1-15% .179 Esta mayor tasa de infecciones puede estar relacionada con comportamientos de toqueteo de los pacientes con ST o con un déficit inmunológico asociado a este síndrome.180
No hay consenso sobre si los pacientes pediátricos tienen mayor riesgo que los adultos.
4.9 CONCLUSIÓN
Los escasos ensayos clínicos realizados con ECP en el ST se han llevado a cabo en un número reducido de casos y la evaluación postoperatoria a corto plazo no han mostrado resultados concluyentes.
Sin embargo, el meta-análisis de estudios abiertos y sobre todo el registro prospectivo de un número importante de pacientes seguidos a medio largo plazo indica que algunos pacientes con ST refractario al tratamiento farmacológico pueden mejorar con ECP (Grado de Recomendación C).
REFERENCIAS
- Jankovic J. Tourette syndrome. Phenomenology and classification of tics. Neurol Clin 1997;15:267-75.
- Novotny M, Valis M, Klimova B. Tourette Syndrome: A Mini-Review. Front Neurol 2018;9:139.
- Leckman JF, Pauls DL, Peterson BS, Riddle MA, Anderson GM, Cohen DJ. Pathogenesis of Tourette syndrome. Clues from the clinical phenotype and natural history. Adv Neurol 1992;58:15-24.
- Scahill LD, Leckman JF, Marek KL. Sensory phenomena in Tourette's syndrome. Adv Neurol 1995;65:273-80.
- Cohen AJ, Leckman JF. Sensory phenomena associated with Gilles de la Tourette's syndrome. J Clin Psychiatry 1992;53:319-23.
- Lang A. Patient perception of tics and other movement disorders. Neurology 1991;41:223-8.
- Hirschtritt ME, Lee PC, Pauls DL, et al. Lifetime prevalence, age of risk, and genetic relationships of comorbid psychiatric disorders in Tourette syndrome. JAMA Psychiatry 2015;72:325-33.
- Cox JH, Seri S, Cavanna AE. Sensory aspects of Tourette syndrome. Neurosci Biobehav Rev 2018;88:170-6.
- Ganos C, Ogrzal T, Schnitzler A, Münchau A. The pathophysiology of echopraxia/echolalia: relevance to Gilles de la Tourette syndrome. Mov Disord 2012;27:1222-9.
- Lombroso PJ, Mack G, Scahill L, King RA, Leckman JF. Exacerbation of Gilles de la Tourette's syndrome associated with thermal stress: a family study. Neurology 1991;41:1984-7.
- Conelea CA, Wellen B, Woods DW, et al. Patterns and Predictors of Tic Suppressibility in Youth With Tic Disorders. Front Psychiatry 2018;9:188.
- Dale RC. Tics and Tourette: a clinical, pathophysiological and etiological review. Curr Opin Pediatr 2017;29:665-73.
- Fish DR, Sawyers D, Allen PJ, Blackie JD, Lees AJ, Marsden CD. The effect of sleep on the dyskinetic movements of Parkinson's disease, Gilles de la Tourette syndrome, Huntington's disease, and torsion dystonia. Arch Neurol 1991;48:210-4.
- Leckman JF, Zhang H, Vitale A, et al. Course of tic severity in Tourette syndrome: the first two decades. Pediatrics 1998;102:14-9.
- Sambrani T, Jakubovski E, Müller-Vahl KR. New Insights into Clinical Characteristics of Gilles de la Tourette Syndrome: Findings in 1032 Patients from a Single German Center. Front Neurosci 2016;10:415.
- Robertson MM. A personal 35 year perspective on Gilles de la Tourette syndrome: prevalence, phenomenology, comorbidities, and coexistent psychopathologies. Lancet Psychiatry 2015;2:68-87.
- Freeman RD, Zinner SH, Müller-Vahl KR, et al. Coprophenomena in Tourette syndrome. Dev Med Child Neurol 2009;51:218-27.
- Ganos C, Edwards MJ, Müller-Vahl K. "I swear it is Tourette's!": On functional coprolalia and other tic-like vocalizations. Psychiatry Res 2016;246:821-6.
- Hassan N, Cavanna AE. The prognosis of Tourette syndrome: implications for clinical practice. Funct Neurol 2012;27:23-7.
- Kompoliti K, Goetz CG. Hyperkinetic movement disorders misdiagnosed as tics in Gilles de la Tourette syndrome. Mov Disord 1998;13:477-80.
- Martino D, Pringsheim TM, Cavanna AE, et al. Systematic review of severity scales and screening instruments for tics: Critique and recommendations. Mov Disord 2017;32:467-73.
- Storch EA, Murphy TK, Geffken GR, et al. Reliability and validity of the Yale Global Tic Severity Scale. Psychol Assess 2005;17:486-91.
- García-López, R P-ME, Romero-González J, Rivas-Ruiz F, Ruiz-García C, Oviedo-Joekes, E dLM-BM. Adaptación al español y validez diagnóstica de la Yale Global Tics Severity Scale Rev Neurol 2008;46:261-6.
- Woods DW, Piacentini J, Himle MB, Chang S. Premonitory Urge for Tics Scale (PUTS): initial psychometric results and examination of the premonitory urge phenomenon in youths with Tic disorders. J Dev Behav Pediatr 2005;26:397-403.
- American Psychiatric Association. Diagnostic and statistical manual of mental disorders (DSM-5®): American Psychiatric Pub; 2013.
- American Psychiatric Association. Diagnostic and statistical manual of mental disorders (DSM-5®): American Psychiatric Pub; 2013.
- Jankovic J, Fahn S. The phenomenology of tics. Movement disorders : official journal of the Movement Disorder Society 1986;1:17-26.
- Robertson MM, Eapen V, Singer HS, et al. Gilles de la Tourette syndrome. Nature reviews Disease primers 2017;3:16097.
- Ganos C, Roessner V, Munchau A. The functional anatomy of Gilles de la Tourette syndrome. Neuroscience and biobehavioral reviews 2013;37:1050-62.
- Leckman JF, Bloch MH, Smith ME, Larabi D, Hampson M. Neurobiological substrates of Tourette's disorder. Journal of child and adolescent psychopharmacology 2010;20:237-47.
- Albin RL, Young AB, Penney JB. The functional anatomy of basal ganglia disorders. Trends in neurosciences 1989;12:366-75.
- Mink JW. The Basal Ganglia and involuntary movements: impaired inhibition of competing motor patterns. Archives of neurology 2003;60:1365-8.
- Albin RL, Young AB, Penney JB. The functional anatomy of disorders of the basal ganglia. Trends in neurosciences 1995;18:63-4.
- Lanciego JL, Luquin N, Obeso JA. Functional neuroanatomy of the basal ganglia. Cold Spring Harbor perspectives in medicine 2012;2:a009621.
- Singer HS. Tourette's syndrome: from behaviour to biology. The Lancet Neurology 2005;4:149-59.
- Felling RJ, Singer HS. Neurobiology of tourette syndrome: current status and need for further investigation. The Journal of neuroscience : the official journal of the Society for Neuroscience 2011;31:12387-95.
- McCairn KW, Bronfeld M, Belelovsky K, Bar-Gad I. The neurophysiological correlates of motor tics following focal striatal disinhibition. Brain : a journal of neurology 2009;132:2125-38.
- Worbe Y, Baup N, Grabli D, et al. Behavioral and movement disorders induced by local inhibitory dysfunction in primate striatum. Cerebral cortex 2009;19:1844-56.
- Grabli D, McCairn K, Hirsch EC, et al. Behavioural disorders induced by external globus pallidus dysfunction in primates: I. Behavioural study. Brain : a journal of neurology 2004;127:2039-54.
- Peterson BS, Thomas P, Kane MJ, et al. Basal Ganglia volumes in patients with Gilles de la Tourette syndrome. Archives of general psychiatry 2003;60:415-24.
- Hyde TM, Stacey ME, Coppola R, Handel SF, Rickler KC, Weinberger DR. Cerebral morphometric abnormalities in Tourette's syndrome: a quantitative MRI study of monozygotic twins. Neurology 1995;45:1176-82.
- Bloch MH, Leckman JF, Zhu H, Peterson BS. Caudate volumes in childhood predict symptom severity in adults with Tourette syndrome. Neurology 2005;65:1253-8.
- Roessner V, Overlack S, Schmidt-Samoa C, et al. Increased putamen and callosal motor subregion in treatment-naive boys with Tourette syndrome indicates changes in the bihemispheric motor network. Journal of child psychology and psychiatry, and allied disciplines 2011;52:306-14.
- Kassubek J, Juengling FD, Ludolph AG. Heterogeneity of voxel-based morphometry findings in Tourette's syndrome: an effect of age? Annals of neurology 2006;59:872-3.
- Singer HS, Reiss AL, Brown JE, et al. Volumetric MRI changes in basal ganglia of children with Tourette's syndrome. Neurology 1993;43:950-6.
- Zimmerman AM, Abrams MT, Giuliano JD, Denckla MB, Singer HS. Subcortical volumes in girls with tourette syndrome: support for a gender effect. Neurology 2000;54:2224-9.
- Makki MI, Behen M, Bhatt A, Wilson B, Chugani HT. Microstructural abnormalities of striatum and thalamus in children with Tourette syndrome. Movement disorders : official journal of the Movement Disorder Society 2008;23:2349-56.
- Neuner I, Kupriyanova Y, Stocker T, et al. Microstructure assessment of grey matter nuclei in adult tourette patients by diffusion tensor imaging. Neuroscience letters 2011;487:22-6.
- Kalanithi PS, Zheng W, Kataoka Y, et al. Altered parvalbumin-positive neuron distribution in basal ganglia of individuals with Tourette syndrome. Proceedings of the National Academy of Sciences of the United States of America 2005;102:13307-12.
- !!! INVALID CITATION !!!
- Bohlhalter S, Goldfine A, Matteson S, et al. Neural correlates of tic generation in Tourette syndrome: an event-related functional MRI study. Brain : a journal of neurology 2006;129:2029-37.
- Muller-Vahl KR, Kaufmann J, Grosskreutz J, Dengler R, Emrich HM, Peschel T. Prefrontal and anterior cingulate cortex abnormalities in Tourette Syndrome: evidence from voxel-based morphometry and magnetization transfer imaging. BMC neuroscience 2009;10:47.
- Peterson BS, Staib L, Scahill L, et al. Regional brain and ventricular volumes in Tourette syndrome. Archives of general psychiatry 2001;58:427-40.
- Sowell ER, Kan E, Yoshii J, et al. Thinning of sensorimotor cortices in children with Tourette syndrome. Nature neuroscience 2008;11:637-9.
- Fahim C, Yoon U, Das S, et al. Somatosensory-motor bodily representation cortical thinning in Tourette: effects of tic severity, age and gender. Cortex; a journal devoted to the study of the nervous system and behavior 2010;46:750-60.
- Tobe RH, Bansal R, Xu D, et al. Cerebellar morphology in Tourette syndrome and obsessive-compulsive disorder. Annals of neurology 2010;67:479-87.
- Ludolph AG, Juengling FD, Libal G, Ludolph AC, Fegert JM, Kassubek J. Grey-matter abnormalities in boys with Tourette syndrome: magnetic resonance imaging study using optimised voxel-based morphometry. The British journal of psychiatry : the journal of mental science 2006;188:484-5.
- Garraux G, Goldfine A, Bohlhalter S, Lerner A, Hanakawa T, Hallett M. Increased midbrain gray matter in Tourette's syndrome. Annals of neurology 2006;59:381-5.
- Peterson BS, Choi HA, Hao X, et al. Morphologic features of the amygdala and hippocampus in children and adults with Tourette syndrome. Archives of general psychiatry 2007;64:1281-91.
- Worbe Y, Gerardin E, Hartmann A, et al. Distinct structural changes underpin clinical phenotypes in patients with Gilles de la Tourette syndrome. Brain : a journal of neurology 2010;133:3649-60.
- Lee JS, Yoo SS, Cho SY, Ock SM, Lim MK, Panych LP. Abnormal thalamic volume in treatment-naive boys with Tourette syndrome. Acta psychiatrica Scandinavica 2006;113:64-7.
- Kates WR, Frederikse M, Mostofsky SH, et al. MRI parcellation of the frontal lobe in boys with attention deficit hyperactivity disorder or Tourette syndrome. Psychiatry research 2002;116:63-81.
- Fredericksen KA, Cutting LE, Kates WR, et al. Disproportionate increases of white matter in right frontal lobe in Tourette syndrome. Neurology 2002;58:85-9.
- Roessner V, Overlack S, Baudewig J, Dechent P, Rothenberger A, Helms G. No brain structure abnormalities in boys with Tourette's syndrome: a voxel-based morphometry study. Movement disorders : official journal of the Movement Disorder Society 2009;24:2398-403.
- Govindan RM, Makki MI, Wilson BJ, Behen ME, Chugani HT. Abnormal water diffusivity in corticostriatal projections in children with Tourette syndrome. Human brain mapping 2010;31:1665-74.
- Neuner I, Kupriyanova Y, Stocker T, et al. White-matter abnormalities in Tourette syndrome extend beyond motor pathways. NeuroImage 2010;51:1184-93.
- Makki MI, Govindan RM, Wilson BJ, Behen ME, Chugani HT. Altered fronto-striato-thalamic connectivity in children with Tourette syndrome assessed with diffusion tensor MRI and probabilistic fiber tracking. Journal of child neurology 2009;24:669-78.
- Thomalla G, Siebner HR, Jonas M, et al. Structural changes in the somatosensory system correlate with tic severity in Gilles de la Tourette syndrome. Brain : a journal of neurology 2009;132:765-77.
- Neuner I, Werner CJ, Arrubla J, et al. Imaging the where and when of tic generation and resting state networks in adult Tourette patients. Frontiers in human neuroscience 2014;8:362.
- Wang Z, Maia TV, Marsh R, Colibazzi T, Gerber A, Peterson BS. The neural circuits that generate tics in Tourette's syndrome. The American journal of psychiatry 2011;168:1326-37.
- Cohen JD, Botvinick M, Carter CS. Anterior cingulate and prefrontal cortex: who's in control? Nature neuroscience 2000;3:421.
- Ziemann U, Paulus W, Rothenberger A. Decreased motor inhibition in Tourette's disorder: evidence from transcranial magnetic stimulation. The American journal of psychiatry 1997;154:1277-84.
- Moll GH, Wischer S, Heinrich H, Tergau F, Paulus W, Rothenberger A. Deficient motor control in children with tic disorder: evidence from transcranial magnetic stimulation. Neuroscience letters 1999;272:37-40.
- Gilbert DL, Batterson JR, Sethuraman G, Sallee FR. Tic reduction with risperidone versus pimozide in a randomized, double-blind, crossover trial. Journal of the American Academy of Child and Adolescent Psychiatry 2004;43:206-14.
- Worbe Y, Palminteri S, Hartmann A, Vidailhet M, Lehericy S, Pessiglione M. Reinforcement learning and Gilles de la Tourette syndrome: dissociation of clinical phenotypes and pharmacological treatments. Archives of general psychiatry 2011;68:1257-66.
- Thomalla G, Jonas M, Baumer T, et al. Costs of control: decreased motor cortex engagement during a Go/NoGo task in Tourette's syndrome. Brain : a journal of neurology 2014;137:122-36.
- Worbe Y, Lehericy S, Hartmann A. Neuroimaging of tic genesis: Present status and future perspectives. Movement disorders : official journal of the Movement Disorder Society 2015;30:1179-83.
- Plessen KJ, Bansal R, Peterson BS. Imaging evidence for anatomical disturbances and neuroplastic compensation in persons with Tourette syndrome. Journal of psychosomatic research 2009;67:559-73.
- Worbe Y, Marrakchi-Kacem L, Lecomte S, et al. Altered structural connectivity of cortico-striato-pallido-thalamic networks in Gilles de la Tourette syndrome. Brain 2015;138:472-82.
- Church JA, Fair DA, Dosenbach NU, et al. Control networks in paediatric Tourette syndrome show immature and anomalous patterns of functional connectivity. Brain : a journal of neurology 2009;132:225-38.
- Church JA, Wenger KK, Dosenbach NU, Miezin FM, Petersen SE, Schlaggar BL. Task control signals in pediatric tourette syndrome show evidence of immature and anomalous functional activity. Frontiers in human neuroscience 2009;3:38.
- Muellner J, Delmaire C, Valabregue R, et al. Altered structure of cortical sulci in gilles de la Tourette syndrome: Further support for abnormal brain development. Movement disorders : official journal of the Movement Disorder Society 2015;30:655-61.
- Worbe Y, Malherbe C, Hartmann A, et al. Functional immaturity of cortico-basal ganglia networks in Gilles de la Tourette syndrome. Brain : a journal of neurology 2012;135:1937-46.
- Wolf SS, Jones DW, Knable MB, et al. Tourette syndrome: prediction of phenotypic variation in monozygotic twins by caudate nucleus D2 receptor binding. Science 1996;273:1225-7.
- Wong DF, Singer HS, Brandt J, et al. D2-like dopamine receptor density in Tourette syndrome measured by PET. Journal of nuclear medicine : official publication, Society of Nuclear Medicine 1997;38:1243-7.
- Wong DF, Brasic JR, Singer HS, et al. Mechanisms of dopaminergic and serotonergic neurotransmission in Tourette syndrome: clues from an in vivo neurochemistry study with PET. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology 2008;33:1239-51.
- Serra-Mestres J, Ring HA, Costa DC, et al. Dopamine transporter binding in Gilles de la Tourette syndrome: a [123I]FP-CIT/SPECT study. Acta psychiatrica Scandinavica 2004;109:140-6.
- Singer HS, Szymanski S, Giuliano J, et al. Elevated intrasynaptic dopamine release in Tourette's syndrome measured by PET. The American journal of psychiatry 2002;159:1329-36.
- Albin RL, Koeppe RA, Bohnen NI, et al. Increased ventral striatal monoaminergic innervation in Tourette syndrome. Neurology 2003;61:310-5.
- Liu H, Dong F, Meng Z, Zhang B, Tan J, Wang Y. Evaluation of Tourette's syndrome by (99m)Tc-TRODAT-1 SPECT/CT imaging. Annals of nuclear medicine 2010;24:515-21.
- Singer HS, Tune LE, Butler IJ, Zaczek R, Coyle JT. Clinical symptomatology, CSF neurotransmitter metabolites, and serum haloperidol levels in Tourette syndrome. Advances in neurology 1982;35:177-83.
- Singer HS, Hahn IH, Moran TH. Abnormal dopamine uptake sites in postmortem striatum from patients with Tourette's syndrome. Annals of neurology 1991;30:558-62.
- Singer HS, Dickson J, Martinie D, Levine M. Second messenger systems in Tourette's syndrome. Journal of the neurological sciences 1995;128:78-83.
- Minzer K, Lee O, Hong JJ, Singer HS. Increased prefrontal D2 protein in Tourette syndrome: a postmortem analysis of frontal cortex and striatum. Journal of the neurological sciences 2004;219:55-61.
- Yoon DY, Gause CD, Leckman JF, Singer HS. Frontal dopaminergic abnormality in Tourette syndrome: a postmortem analysis. Journal of the neurological sciences 2007;255:50-6.
- Singer HS, Hong JJ, Rippel CA, Pardo CA. The need for caution in considering the diagnostic utility of antibasal ganglia antibodies in movement disorders. Archives of disease in childhood 2004;89:595-7.
- Steeves TD, Ko JH, Kideckel DM, et al. Extrastriatal dopaminergic dysfunction in tourette syndrome. Annals of neurology 2010;67:170-81.
- Singer HS, Minzer K. Neurobiology of Tourette's syndrome: concepts of neuroanatomic localization and neurochemical abnormalities. Brain and Development 2003;25:S70-S84.
- Behen M, Chugani HT, Juhasz C, et al. Abnormal brain tryptophan metabolism and clinical correlates in Tourette syndrome. Movement disorders : official journal of the Movement Disorder Society 2007;22:2256-62.
- Haugbol S, Pinborg LH, Regeur L, et al. Cerebral 5-HT2A receptor binding is increased in patients with Tourette's syndrome. The international journal of neuropsychopharmacology 2007;10:245-52.
- Barr CL, Wigg KG, Pakstis AJ, et al. Genome scan for linkage to Gilles de la Tourette syndrome. American journal of medical genetics 1999;88:437-45.
- Tourette Syndrome Association International Consortium for G. Genome scan for Tourette disorder in affected-sibling-pair and multigenerational families. American journal of human genetics 2007;80:265-72.
- Adamczyk A, Gause CD, Sattler R, et al. Genetic and functional studies of a missense variant in a glutamate transporter, SLC1A3, in Tourette syndrome. Psychiatric genetics 2011;21:90-7.
- Anderson GM, Pollak ES, Chatterjee D, Leckman JF, Riddle MA, Cohen DJ. Postmortem analysis of subcortical monoamines and amino acids in Tourette syndrome. Advances in neurology 1992;58:123-33.
- Kataoka Y, Kalanithi PS, Grantz H, et al. Decreased number of parvalbumin and cholinergic interneurons in the striatum of individuals with Tourette syndrome. The Journal of comparative neurology 2010;518:277-91.
- Steinberg T, Shmuel Baruch S, Harush A, et al. Tic disorders and the premonitory urge. Journal of neural transmission 2010;117:277-84.
- Rajagopal S, Seri, Cavanna AE. Premonitory urges and sensorimotor processing in Tourette syndrome. Behavioural neurology 2013;27:65-73.
- Hampson M, Tokoglu F, King RA, Constable RT, Leckman JF. Brain areas coactivating with motor cortex during chronic motor tics and intentional movements. Biological psychiatry 2009;65:594-9.
- Draganski B, Martino D, Cavanna AE, et al. Multispectral brain morphometry in Tourette syndrome persisting into adulthood. Brain : a journal of neurology 2010;133:3661-75.
- Fried I, Katz A, McCarthy G, et al. Functional organization of human supplementary motor cortex studied by electrical stimulation. The Journal of neuroscience : the official journal of the Society for Neuroscience 1991;11:3656-66.
- Makris N, Kennedy DN, McInerney S, et al. Segmentation of subcomponents within the superior longitudinal fascicle in humans: a quantitative, in vivo, DT-MRI study. Cerebral cortex 2005;15:854-69.
- Berman BD, Horovitz SG, Morel B, Hallett M. Neural correlates of blink suppression and the buildup of a natural bodily urge. NeuroImage 2012;59:1441-50.
- Leknes SG, Bantick S, Willis CM, Wilkinson JD, Wise RG, Tracey I. Itch and motivation to scratch: an investigation of the central and peripheral correlates of allergen- and histamine-induced itch in humans. Journal of neurophysiology 2007;97:415-22.
- Jackson SR, Parkinson A, Kim SY, Schuermann M, Eickhoff SB. On the functional anatomy of the urge-for-action. Cognitive neuroscience 2011;2:227-43.
- Ganos C, Garrido A, Navalpotro-Gomez I, et al. Premonitory urge to tic in Tourette's is associated with interoceptive awareness. Movement disorders : official journal of the Movement Disorder Society 2015;30:1198-202.
- Tinaz S, Malone P, Hallett M, Horovitz SG. Role of the right dorsal anterior insula in the urge to tic in Tourette syndrome. Movement disorders : official journal of the Movement Disorder Society 2015;30:1190-7.
- Ganos C, Rothwell J, Haggard P. Voluntary inhibitory motor control over involuntary tic movements. Movement disorders : official journal of the Movement Disorder Society 2018.
- Martin-Rodriguez JF, Ruiz-Rodriguez MA, Palomar FJ, et al. Aberrant cortical associative plasticity associated with severe adult Tourette syndrome. Movement disorders : official journal of the Movement Disorder Society 2015;30:431-5.
- Ganos C, Asmuss L, Bongert J, Brandt V, Munchau A, Haggard P. Volitional action as perceptual detection: predictors of conscious intention in adolescents with tic disorders. Cortex; a journal devoted to the study of the nervous system and behavior 2015;64:47-54.
- Ganos C, Bongert J, Asmuss L, Martino D, Haggard P, Munchau A. The somatotopy of tic inhibition: Where and how much? Movement disorders : official journal of the Movement Disorder Society 2015;30:1184-9.
- Draper A, Stephenson MC, Jackson GM, et al. Increased GABA contributes to enhanced control over motor excitability in Tourette syndrome. Current biology : CB 2014;24:2343-7.
- Plessen KJ, Wentzel-Larsen T, Hugdahl K, et al. Altered interhemispheric connectivity in individuals with Tourette's disorder. The American journal of psychiatry 2004;161:2028-37.
- Ganos C, Kuhn S, Kahl U, et al. Prefrontal cortex volume reductions and tic inhibition are unrelated in uncomplicated GTS adults. Journal of psychosomatic research 2014;76:84-7.
- Ganos C, Kahl U, Brandt V, et al. The neural correlates of tic inhibition in Gilles de la Tourette syndrome. Neuropsychologia 2014;65:297-301.
- Deckersbach T, Chou T, Britton JC, et al. Neural correlates of behavior therapy for Tourette's disorder. Psychiatry research 2014;224:269-74.
- Roessner V, Rothenberger A, Rickards H, Hoekstra PJ. European clinical guidelines for Tourette syndrome and other tic disorders. Eur Child Adolesc Psychiatry 2011;20:153-4.
- Cath DC, Hedderly T, Ludolph AG, et al. European clinical guidelines for Tourette syndrome and other tic disorders. Part I: assessment. Eur Child Adolesc Psychiatry 2011;20:155-71.
- Roessner V, Plessen KJ, Rothenberger A, et al. European clinical guidelines for Tourette syndrome and other tic disorders. Part II: pharmacological treatment. Eur Child Adolesc Psychiatry 2011;20:173-96.
- Verdellen C, van de Griendt J, Hartmann A, Murphy T, Group EG. European clinical guidelines for Tourette syndrome and other tic disorders. Part III: behavioural and psychosocial interventions. Eur Child Adolesc Psychiatry 2011;20:197-207.
- Muller-Vahl KR, Cath DC, Cavanna AE, et al. European clinical guidelines for Tourette syndrome and other tic disorders. Part IV: deep brain stimulation. Eur Child Adolesc Psychiatry 2011;20:209-17.
- Sandor P, Carroll A. Canadian guidelines for the evidence-based treatment of tic disorders. Can J Psychiatry 2012;57:131-2.
- Pringsheim T, Doja A, Gorman D, et al. Canadian guidelines for the evidence-based treatment of tic disorders: pharmacotherapy. Can J Psychiatry 2012;57:133-43.
- Steeves T, McKinlay BD, Gorman D, et al. Canadian guidelines for the evidence-based treatment of tic disorders: behavioural therapy, deep brain stimulation, and transcranial magnetic stimulation. Can J Psychiatry 2012;57:144-51.
- Murphy TK, Lewin AB, Storch EA, Stock S. Practice parameter for the assessment and treatment of children and adolescents with tic disorders. J Am Acad Child Adolesc Psychiatry 2013;52:1341-59.
- Whittington C, Pennant M, Kendall T, et al. Practitioner Review: Treatments for Tourette syndrome in children and young people - a systematic review. J Child Psychol Psychiatry 2016;57:988-1004.
- Quezada J, Coffman KA. Current Approaches and New Developments in the Pharmacological Management of Tourette Syndrome. CNS Drugs 2018;32:33-45.
- dos Santos Junior A, Henriques TB, de Mello MP, et al. Hyperprolactinemia in Children and Adolescents with Use of Risperidone: Clinical and Molecular Genetics Aspects. J Child Adolesc Psychopharmacol 2015;25:738-48.
- Yoo HK, Joung YS, Lee JS, et al. A multicenter, randomized, double-blind, placebo-controlled study of aripiprazole in children and adolescents with Tourette's disorder. J Clin Psychiatry 2013;74:e772-80.
- Sallee F, Kohegyi E, Zhao J, et al. Randomized, Double-Blind, Placebo-Controlled Trial Demonstrates the Efficacy and Safety of Oral Aripiprazole for the Treatment of Tourette's Disorder in Children and Adolescents. J Child Adolesc Psychopharmacol 2017;27:771-81.
- Gaffney GR, Perry PJ, Lund BC, Bever-Stille KA, Arndt S, Kuperman S. Risperidone versus clonidine in the treatment of children and adolescents with Tourette's syndrome. J Am Acad Child Adolesc Psychiatry 2002;41:330-6.
- Allen AJ, Kurlan RM, Gilbert DL, et al. Atomoxetine treatment in children and adolescents with ADHD and comorbid tic disorders. Neurology 2005;65:1941-9.
- Jankovic J, Jimenez-Shahed J, Brown LW. A randomised, double-blind, placebo-controlled study of topiramate in the treatment of Tourette syndrome. J Neurol Neurosurg Psychiatry 2010;81:70-3.
- Jankovic J. Dopamine depleters in the treatment of hyperkinetic movement disorders. Expert Opin Pharmacother 2016;17:2461-70.
- Marras C, Andrews D, Sime E, Lang AE. Botulinum toxin for simple motor tics: a randomized, double-blind, controlled clinical trial. Neurology 2001;56:605-10.
- Pandey S, Srivanitchapoom P, Kirubakaran R, Berman BD. Botulinum toxin for motor and phonic tics in Tourette's syndrome. Cochrane Database Syst Rev 2018;1:CD012285.
- Farag M, Stern JS, Simmons H, Robertson MM. Serial pharmacological prescribing practices for tic management in Tourette syndrome. Hum Psychopharmacol 2015;30:435-41.
- Wilhelm S, Peterson AL, Piacentini J, et al. Randomized trial of behavior therapy for adults with Tourette syndrome. Arch Gen Psychiatry 2012;69:795-803.
- Nissen JB, Kaergaard M, Laursen L, Parner E, Thomsen PH. Combined habit reversal training and exposure response prevention in a group setting compared to individual training: a randomized controlled clinical trial. Eur Child Adolesc Psychiatry 2018.
- Wilhelm S, Deckersbach T, Coffey BJ, Bohne A, Peterson AL, Baer L. Habit reversal versus supportive psychotherapy for Tourette's disorder: a randomized controlled trial. Am J Psychiatry 2003;160:1175-7.
- Verdellen CW, Keijsers GP, Cath DC, Hoogduin CA. Exposure with response prevention versus habit reversal in Tourettes's syndrome: a controlled study. Behav Res Ther 2004;42:501-11.
- Piacentini J, Woods DW, Scahill L, et al. Behavior therapy for children with Tourette disorder: a randomized controlled trial. JAMA 2010;303:1929-37.
- Grados M, Huselid R, Duque-Serrano L. Transcranial Magnetic Stimulation in Tourette Syndrome: A Historical Perspective, Its Current Use and the Influence of Comorbidities in Treatment Response. Brain Sci 2018;8.
- Landeros-Weisenberger A, Mantovani A, Motlagh MG, et al. Randomized Sham Controlled Double-blind Trial of Repetitive Transcranial Magnetic Stimulation for Adults With Severe Tourette Syndrome. Brain Stimul 2015;8:574-81.
- Sescs S. Estimulación Cerebral Profunda En Trastornos Neurológicos Y Psiquiátricos. Rev Médica Clínica Las Condes [Internet] 2016;27(3):401–3. Available at: http://linkinghub.elsevier.com/retrieve/pii/S0716864016300402.
- Houeto JL, Karachi C, Mallet L, et al. Tourette's syndrome and deep brain stimulation. J Neurol Neurosurg Psychiatry 2005;76:992-5.
- Kefalopoulou Z, Zrinzo L, Jahanshahi M, et al. Bilateral globus pallidus stimulation for severe Tourette's syndrome: a double-blind, randomised crossover trial. Lancet Neurol 2015;14:595-605.
- Maciunas RJ, Maddux BN, Riley DE, et al. Prospective randomized double-blind trial of bilateral thalamic deep brain stimulation in adults with Tourette syndrome. J Neurosurg 2007;107:1004-14.
- Schoenberg MR, Maddux BN, Riley DE, et al. Five-months-postoperative neuropsychological outcome from a pilot prospective randomized clinical trial of thalamic deep brain stimulation for Tourette syndrome. Neuromodulation 2015;18:97-104.
- Welter ML, Mallet L, Houeto JL, et al. Internal pallidal and thalamic stimulation in patients with Tourette syndrome. Arch Neurol 2008;65:952-7.
- Welter ML, Houeto JL, Thobois S, et al. Anterior pallidal deep brain stimulation for Tourette's syndrome: a randomised, double-blind, controlled trial. Lancet Neurol 2017;16:610-9.
- Ackermans L, Duits A, van der Linden C, et al. Double-blind clinical trial of thalamic stimulation in patients with Tourette syndrome. Brain 2011;134:832-44.
- Martinez-Ramirez D, Jimenez-Shahed J, Leckman JF, et al. Efficacy and Safety of Deep Brain Stimulation in Tourette Syndrome: The International Tourette Syndrome Deep Brain Stimulation Public Database and Registry. JAMA Neurol 2018;75:353-9.
- Baldermann JC, Schuller T, Huys D, et al. Deep Brain Stimulation for Tourette-Syndrome: A Systematic Review and Meta-Analysis. Brain Stimul 2016;9:296-304.
- Schrock LE, Mink JW, Woods DW, et al. Tourette syndrome deep brain stimulation: a review and updated recommendations. Mov Disord 2015;30:448-71.
- Vandewalle V, van der Linden C, Groenewegen HJ, et al. Stereotactic treatment of Gilles de la Tourette syndrome by high frequency stimulation of thalamus. Lancet [Internet] 1999;353(9154):724. Available at: http://scholar.google.com/scholar?hl=en&btnG=Search&q=intitle:Stereotactic+treatment+of+Gilles+de+la+Tourette+syndrome+by+high+frequency+stimulation+of+thalamus#0.
- Jo HJ, McCairn KW, Gibson WS, et al. Global network modulation during thalamic stimulation for Tourette syndrome. NeuroImage Clin [Internet] 2018;18(January):502–9. Available at: https://doi.org/10.1016/j.nicl.2018.02.018.
- Smeets A, Duits AA, Horstkotter D, et al. Ethics of Deep Brain Stimulation in Adolescent Patients with Refractory Tourette Syndrome: a Systematic Review and Two Case Discussions. Neuroethics 2018;11:143-55.
- Neudorfer C, El Majdoub F, Hunsche S, Richter K, Sturm V, Maarouf M. Deep Brain Stimulation of the H Fields of Forel Alleviates Tics in Tourette Syndrome. Front Hum Neurosci [Internet] 2017;11(June). Available at: http://journal.frontiersin.org/article/10.3389/fnhum.2017.00308/full.
- Leckman JF, Riddle MA, Hardin MT, et al. The Yale Global Tic Severity Scale: initial testing of a clinician-rated scale of tic severity. J Am Acad Child Adolesc Psychiatry 1989;28:566-73.
- Martinez-Fernandez R, Zrinzo L, Aviles-Olmos I, et al. Deep brain stimulation for Gilles de la Tourette syndrome: a case series targeting subregions of the globus pallidus internus. Mov Disord 2011;26:1922-30.
- Goetz CG, Pappert EJ, Louis ED, Raman R, Leurgans S. Advantages of a modified scoring method for the Rush Video-Based Tic Rating Scale. Mov Disord 1999;14:502-6.
- Akbarian-Tefaghi L, Akram H, Johansson J, et al. Refining the Deep Brain Stimulation Target within the Limbic Globus Pallidus Internus for Tourette Syndrome. Stereotact Funct Neurosurg 2017;95:251-8.
- Jimenez-Shahed J. Design challenges for stimulation trials of Tourette's syndrome. Lancet Neurol 2015;14:563-5.
- Almeida L, Martinez-Ramirez D, Rossi PJ, Peng Z, Gunduz A, Okun MS. Chasing tics in the human brain: development of open, scheduled and closed loop responsive approaches to deep brain stimulation for tourette syndrome. J Clin Neurol 2015;11:122-31.
- Molina R, Okun MS, Shute JB, et al. Report of a patient undergoing chronic responsive deep brain stimulation for Tourette syndrome: proof of concept. J Neurosurg [Internet] 2017;1–7. Available at: http://thejns.org/doi/10.3171/2017.6.JNS17626.
- Marceglia S, Rosa M, Servello D, et al. Adaptive Deep Brain Stimulation (aDBS) for Tourette Syndrome. Brain Sci 2017;8.
- Haense C, Muller-Vahl KR, Wilke F, et al. Effect of Deep Brain Stimulation on Regional Cerebral Blood Flow in Patients with Medically Refractory Tourette Syndrome. Front Psychiatry 2016;7:118.
- Hariz MI. Complications of deep brain stimulation surgery. Mov Disord 2002;17 Suppl 3:S162-6.
- Elamin I, Edwards MJ, Martino D. Immune dysfunction in Tourette syndrome. Behav Neurol 2013;27:23-32.
MATERIAL SUPLEMENTARIO
Página web del Registro Internacional de Síndrome de Tourette y Estimulación Cerebral Profunda:
https: //tourettedeepbrainstimulationregistry.ese.ufhealth.org/
| Capítulo 1: Definición del síndrome de Tourette y diagnóstico diferencial. | INDICE | Capítulo 3: Trastornos afectivos y cognitivos en el síndrome de Tourette del adulto. |
