Coordinadora del Capítulo:
María Cruz Rodriguez-Oroz. Departamento de Neurología, Unidad de Trastornos del Movimiento, Clínica Universidad de Navarra; Área de Neurociencias, Centro de Investigación Médica Aplicada (CIMA), Pamplona.
Autores: María Cruz Rodriguez-Oroz1, Juan Carlos Gómez Esteban2, Juan Carlos Martínez Castrillo3, Mónica Kurtis4, Diego Santos García5, Mar Carmona Abellán6
1 Departamento de Neurología, Unidad de Trastornos del Movimiento, Clínica Universidad de Navarra; Área de Neurociencias, Centro de Investigación Médica Aplicada (CIMA), Pamplona.
2 Servicio de Neurología, Hospital Universitario Cruces; Unidad de Neurociencias, Instituto de Investigación Biocruces, Barakaldo, Vizcaya.
3 Servicio de Neurología, Unidad de Trastornos del Movimiento. Hospital Universitario Ramón y Cajal, Madrid
4 Unidad de Trastornos del Movimiento, Servicio de Neurología, Hospital Ruber Internacional, Madrid.
5 Servicio de Neurología, Hospital Arquitecto Marcide y Hospital Naval, CHUAC (Complejo Hospitalario Universitario de A Coruña), A Coruña.
6 Unidad de Neurociencias, Instituto de Investigación Biocruces, Barakaldo, Vizcaya.
Índice:
- 1. Fenomenología del trastorno obsesivo-compulsivo (TOC) en el síndrome de Tourette. Juan Carlos Martínez Castrillo.
4.2. Bases neurofisiológicas. Juan Carlos Gomez Estaban, Mar Carmona
4.3. Tratamiento. Monica Kurtis, Diego Santos
Resumen
El trastorno obsesivo compulsivo (TOC) ocurre en aproximadamente el 50% de pacientes con Síndrome de Tourette (ST) siendo la alteración neuropsiquiátrica mas frecuente después del trastorno por déficit de atención e hiperactividad (TDAH) y generando una gran alteración en la calidad de vida. Se diferencian conductas o síntomas obsesivo-compulsivos y TOC en función del grado de angustia que se asocia. Mientras que los tics, característicos del ST, son movimientos repetitivos, las conductas repetitivas configuran el TOC. A diferencia de los casos de TOC puro, los TOCs en el ST tienen más frecuentemente contenido violento, sexual o de simetría con conductas de parpadeo, contaje y autolesivas. Tics y TOCs coexisten en el ST y comparten rasgos como son el inicio en la edad infanto-juvenil, curso remitente-recurrente y urgencias premonitorias: sensaciones corporales que se alivian con el tic o pensamientos irreprimibles y angustiosos que se alivian con la realización de la compulsión en el TOC. Sin embargo, este limite es difuso ya que existen tics complejos que remedan TOC y viceversa y frecuentemente ambos coexisten haciendo a veces difícil el diagnostico diferencial y sugiriendo un continuum tanto en la expresión clínica como en los mecanismos subyacentes.
La fisopatología del TOC en el ST es compleja y no bien comprendida. Se han descrito alteraciones en los sistemas de neurotransmisión, sobretodo de serotonina pero también de dopamina y glutamato, factores genéticos con una herencia probablemente poligénica, y disfunción en los circuitos cerebrales responsables del control inhibitorio y la función ejecutiva que comprenden áreas como la corteza frontal medial, corteza prefrontal ventrolateral y dorsolateral, insula, opérculo anterior, corteza parietal, cíngulo y cortex orbitofrontal. Por otra parte, existe una disfunción de la amígdala y circuito límbico que explicaría la ansiedad y angustia asociada al TOC. Esta disfunción da lugar a que estos pacientes evalúen los errores y las amenazas de un modo exagerado y sean incapaces de adaptar la conducta y el pensamiento a situaciones nuevas o inesperadas, produciendo inseguridad y angustia que junto con un déficit de inhibición en la respuesta desencadena la realización de compulsiones y comportamientos repetitivos para liberar esta sensación.
El tratamiento del TOC en el ST comprende la terapia cognitivo conductual (TCC), el uso de fármacos y la cirugía con estimulación cerebral profunda (ECP) en función de la gravedad del mismo. El tratamiento farmacológico debe individualizarse teniendo en cuenta el contexto familiar/social y otras comorbilidades dentro del espectro Tourette. En caso de TOC leve debe iniciarse TCC y, si no hay mejoría, añadir un ISRS, preferiblemente fluoxetina, fluvoxamina o sertralina. Es preferible la combinación de ISRS con TCC que un ISRS solo. Si el TOC es moderado a grave se debe plantear desde el inicio la terapia combinada (ISRS + TCC). Si no hay respuesta con un ISRS, se debe considerar cambiar a otro ISRS, a clomipramina o asociar clomipramina o un antipsicótico atípico. Si no hay respuesta a todas las posibilidades previas, valorar combinar otros fármacos (glutamatérgicos, opiáceos, otros antidepresivos, etc.). En casos refractarios y graves puede valorarse la cirugía con ECP.
4.1. Fenomenología del trastorno obsesivo-compulsivo en el Síndrome de Tourette
Juan Carlos Martínez Castrillo.
| Tabla 1: Comorbilidad de trastornos neuropsiquiátricos en el síndrome de Tourette | ||||
|---|---|---|---|---|
|
Sexo |
||||
|
Todos los pacientes con ST (n=1363) (%) |
Varones (n=1006, 73%) (%) |
Mujeres (%) |
P |
|
|
Trastorno obsesivo compulsivo (TOC) |
50.0 |
47.4 |
57.1 |
0.002 |
|
Trastorno por déficit de atención e hiperactividad (TDAH) |
54.3 |
58.6 |
42.3 |
<0.001 |
|
TOC + TDAH |
72.1 |
|||
|
Síndrome de Tourette aislado |
14.3 |
|||
|
Trastornos del humor |
29.8 |
26.7 |
38.8 |
<0.001 |
|
Depresión mayor |
26.1 |
22.8 |
35.4 |
<0.001 |
|
Trastornos por ansiedad |
36.1 |
32.0 |
48.0 |
<0.001 |
|
Ansiedad generalizada |
11.2 |
9.0 |
17.4 |
<0.001 |
|
Trastorno por pánico |
6.7 |
4.3 |
13.6 |
<0.001 |
|
Agorafobia sin pánico |
1.0 |
1.3 |
0.0 |
n.s. |
|
Estrés postraumático |
3.2 |
8.1 |
1.2 |
<0.001 |
|
Ansiedad por separación |
15.1 |
13.5 |
21.1 |
0.03 |
|
Fobia social |
9.0 |
12.7 |
7.8 |
0.02 |
|
Fobia específica |
15.1 |
12.0 |
23.9 |
<0.001 |
|
Trastornos del comportamiento |
29,7 |
31,9 |
21,7 |
0.03 |
|
Comportamiento desafiante-oposicionista |
29.3 |
31.4 |
21.4 |
0.03 |
|
Trastornos de la alimentación |
2.0 |
0.3 |
7.0 |
<0.001 |
|
Anorexia nerviosa |
1.0 |
0.1 |
3.3 |
<0.001 |
|
Bulimia |
1.3 |
0.1 |
4.5 |
<0.001 |
|
Psicosis |
0.8 |
0.7 |
0.8 |
n.s. |
|
Trastornos por abuso de sustancias |
6.2 |
6.0 |
6.9 |
n.s. |
|
Enuresis / Encopresis |
14.7 / 3.2 |
15.5 / 3.7 |
11.7 / 1.7 |
n.s. |
|
Número de comorbilidades, media (DE) |
2.1 (1.6) |
2.0 (1.5) |
2.2 (1.8) |
n.s. |
|
Número de comorbilidades excluyendo TOC y TDAH, media (DE) |
0.9 (1.3) |
0.8 (1.2) |
1.1 (1.5) |
<0.01 |
|
Otros (Freeman et al, 2000) |
n=2846 |
N=654 |
||
|
Tartamudeo |
9.0 |
5.0 |
<0.05 |
|
|
Tricotilomanía |
2.4 |
4.0 |
<0.05 |
|
|
Coprolalia |
14.0 |
15.0 |
n.s. |
|
Las manifestaciones neuropsiquiátricas (Tabla 1) son comunes en el síndrome de Tourette (ST) y, en general, son más perturbadoras que los propios tics 1–4. En diversos estudios con una muestra importante de pacientes con ST, solo el 10-15% estaba libre de algún tipo de comorbilidad neuropsiquiátrica 1,5–8, lo que hace pensar si esta sintomatología es realmente una parte genuina de la enfermedad, o si toda una serie de trastornos que podrían estar relacionados con el desarrollo neuropsicológico podrían ser un mismo proceso con diversos fenotipos 1–3,9,10 . La comorbilidad neuropsiquiátrica más común en el ST es el trastorno por déficit de atención e hiperactividad (TDAH) (55-68%), seguido de conductas obsesivo-compulsivas (32-45%) y trastorno obsesivo-compulsivo (TOC) (27-60%). Es interesante observar que el ST asociado a TDAH es más frecuente en varones, mientras que la asociación con TOC es más frecuente en las mujeres 1.
4.1.1. Semiología del TOC
Las conductas repetitivas pueden aparecer en un gran número de alteraciones neurológicas y psiquiátricas. Es posible presenciar movimientos simples que, aunque se toman como fisiológicos, ocurren con una frecuencia o en un contexto anormal, como tics, estereotipias o gestos, y conductas mas complejas como las compulsiones. En las compulsiones, hablamos de comportamientos más que de movimientos.
En el ST debe distinguirse entre conductas obsesivo-compulsivas (o síntomas obsesivo-compulsivos) y TOC. Las conductas o síntomas obsesivo-compulsivos son egosintónicos, no se asocian a angustia, mientras que el TOC sería egodistónico, es decir, inquietan al individuo 2,10. Asi, la ansiedad contextual es primordial y, en la mayoría, la evaluación clínica permite la identificación de los fenómenos obsesivos que sustentan esos comportamientos. 1,5,11
La DSM-5 12 define las obsesiones por (1) y (2): (1). Pensamientos, impulsos o imágenes recurrentes y persistentes que se experimentan, en algún momento durante el trastorno, como intrusas o no deseadas, y que en la mayoría de los sujetos causan ansiedad o malestar importante. (2). El sujeto intenta ignorar o suprimir estos pensamientos, impulsos o imágenes, o neutralizarlos con algún otro pensamiento o acto (es decir, realizando una compulsión).
Las compulsiones se definen por (1) y (2): (1). Comportamientos (p. ej., lavarse las manos, ordenar, comprobar las cosas) o actos mentales (p. ej., rezar, contar, repetir palabras en silencio) repetitivos que el sujeto realiza como respuesta a una obsesión o de acuerdo con reglas que ha de aplicar de manera rígida. (2). El objetivo de los comportamientos o actos mentales es prevenir o disminuir la ansiedad o el malestar, o evitar algún suceso o situación temida; sin embargo, estos comportamientos o actos mentales no están conectados de una manera realista con los destinados a neutralizar o prevenir, o bien resultan claramente excesivos. Debe tenerse en cuenta que los niños de corta edad pueden no ser capaces de articular los objetivos de estos comportamientos o actos mentales.
Otro aspecto importante es la distinción entre rituales normales y conductas compulsivas en el contexto del TOC. Mientras que los rituales en niños y adultos corresponden a reglas y hábitos que contribuyen a estructurar la vida diaria, las compulsiones en el TOC son comportamientos excesivos y repetidos que los pacientes se ven obligados a realizar para aliviar su ansiedad y en respuesta a ideas intrusivas e incontrolables; realizar la compulsión alivia temporalmente o interrumpe estos pensamientos, que están etiquetados como "obsesiones" 11,13. Como tal, el TOC también debe distinguirse de las estereotipias, comportamientos que pueden considerarse repetitivos, pero no dirigidos a un objetivo 11. Las personas que sufren TOC describen una ansiedad intensa y abrumadora cuando se ven obligados a enfrentar sus obsesiones. Describen los sentimientos de incomodidad y malestar como la fuerza impulsora detrás de las acciones compulsivas correspondientes. Estas conductas rituales, cuando se realizan adecuadamente, pueden proporcionar sentimientos temporales no solo de alivio sino también de satisfacción 13,14 . Otra manifestación del TOC son los comportamientos de evitación como resultado de los intentos de eludir los factores desencadenantes de la obsesión 9,14. Por ejemplo, los pacientes con obsesiones por contaminación evitan los baños públicos, mientras que los que tienen miedo de provocar una catástrofe pueden dejar de conducir.
Los principales tipos de TOC que distingue la DSM-5 son: (1) las obsesiones relacionadas con la limpieza o el temor a la contaminación asociada con los rituales de lavado; (2) obsesiones relacionadas con el miedo a hacerse daño a uno mismo o a los cercanos asociados con el control de rituales; (3) obsesiones de simetría u orden asociada con rituales o compulsiones repetitivas; y (4) ideas obsesivas vinculadas a tabúes, como la sexualidad o la blasfemia religiosa, asociadas con el control de comportamientos y / o rituales de purificación.
4.1.2. ¿Tics ó TOCs?
Los movimientos repetitivos son el marchamo de los tics crónicos característicos del ST, mientras que los comportamientos repetitivos son característicos del TOC 2,9,11. Es frecuente en la clínica del ST hablar de tics y TOCs. Ambos trastornos tienden a coexistir con frecuencia, ya que un número sustancial de pacientes con ST, que por definición presentan tics, también padecen TOC y viceversa 9,11 . Además, ambos trastornos tienen un inicio juvenil o adulto joven, un curso remitente-recurrente y se caracterizan por la presencia de conductas repetitivas y urgencias premonitorias. La distinción clínica entre tics y TOCs parece fácil a priori. Movimiento y comportamiento, esa es la principal distinción. Cuando los síntomas se caracterizan por una disfunción del movimiento generalmente provocada por un impulso o sensación premonitoria de moverse hablamos de tic y donde el comportamiento repetitivo es la respuesta a un conjunto incontrolable e irreprimible de pensamientos estamos ante un TOC. Sin embargo, en el ST el movimiento repetitivo complejo puede simular un TOC, mientras que el TOC de inicio temprano se asocia con frecuencia con tics complejos 1,2,5,9,11
Debido a que ambos trastornos a veces se presentan como excesivos o en secuencias que conducen a dificultades en la vida cotidiana, la superposición entre los síndromes no es inusual, lo que hace que el diagnóstico diferencial sea complicado en algunos casos. La probabilidad de padecer un TOC a lo largo de la vida en pacientes con ST es del 50% 1,5, mientras que alrededor del 30% de los pacientes con TOC también muestran tics 9,14.
La edad de aparición de tics y TOC difiere. Los tics generalmente comienzan en la infancia, mientras que el TOC comienza a manifestarse en la adolescencia tardía o al principio de la edad adulta. Aunque el TOC puede considerarse un trastorno del desarrollo neurológico, es sorprendente que los tics se observen predominantemente en el TOC de inicio temprano, pero con mucha menos frecuencia se asocian con el TOC de inicio tardío 1,5. La superposición temporal y sintomática podría ser un argumento a favor de un continuum entre los dos síndromes, y hay argumentos en ambos sentidos. En un gran estudio francés de pacientes adultos con ST, dos tercios mostraron conductas repetitivas 9. Cuando estos comportamientos fueron analizados por un psiquiatra y un neurólogo, encontraron proporciones iguales de tics y TOC, pero una cuarta parte de los pacientes también mostraron formas mixtas que podrían corresponder a tics o TOC. Desde un punto de vista fenomenológico, las conductas relacionadas con la limpieza y el control pueden atribuirse inequívocamente al TOC, mientras que en las formas límite, predominaron las obsesiones de contar y simetría, así como los comportamientos de tocamiento, limpieza y mantener la exactitud 15. Los pacientes con ST y TOC se asociaron significativamente con los síntomas más graves del ST, como contar forzadamente, así como coprofenomenología y ecofenomenología 9.
4.1.3 Fenomenología del TOC en el ST.
Tres estudios de cohortes encontraron diferencias significativas entre los pacientes con ST puro, TOC puro y aquellos con ST y TOC 16–18. Utilizando diferentes instrumentos, vieron que los pacientes con ST decían más obscenidades, imitaban los movimientos de los demás, tenían ideas de contaje e impulsos de conductas autolesivas. Las obsesiones incluían temas sexuales y violentos. Las compulsiones incluían las relativas a la simetría, decir o hacer cosas de una manera muy particular y contacto forzado. Todas las obsesiones y compulsiones ocurrieron de novo. Por el contrario, los pacientes con TOC preferían hacer las cosas en un orden específico, organizar objetos, contar, tocarse y limpiar. Todas estas compulsiones fueron precedidas por pensamientos obsesivos. Estas obsesiones incluyeron miedo a contaminarse, miedo a que algo malo vaya a suceder o pensamientos sobre personas que se hacen daño entre sí. Los pacientes con ST y TOC tenían obsesiones más violentas, sexuales y de simetría, así como conductas y compulsiones de tocamiento, parpadeo, contaje y autolesivas. En este grupo de pacientes, las compulsiones surgieron espontáneamente. Comparando pacientes que tenían ST puro con pacientes con ST con TOC, se observó que la comorbilidad con TOC se correlacionaba con tics más graves, ecofenómenos, comorbilidad con TDAH y depresión 18.
Cuando se compararon pacientes adultos con ST con pacientes adultos que tenían un trastorno depresivo mayor y controles sanos, se vio que los pacientes con ST no presentaban diferencias en las obsesiones con aquellos con una depresión mayor, y sí tenían puntuaciones significativamente más bajas en las medidas de depresión y ansiedad. Esto sugirió a los autores que las obsesiones son características del ST 19.
También se ha comparado la fenomenología de las obsesiones entre pacientes con síndrome de Tourette y pacientes con epilepsia del lóbulo temporal. Se encontraron diferencias en el contenido de las obsesiones: mientras que en los pacientes con ST se centraron predominantemente en la sexualidad y la impulsividad, en los pacientes con epilepsia del lóbulo temporal se centraron en los pensamientos existenciales 20.
Desde una perspectiva poblacional, puede concluirse que hay diferencias clínicas y fenomenológicas en las obsesiones-compulsiones entre los pacientes con TOC primarios y los pacientes con ST. A nivel individual las diferencias entre tics y TOCs son sencillas, aunque en casos complejos las similitudes pueden hacer permeable los límites que los distinguen puesto que es frecuente que coexistan pacientes con ST y TOC y viceversa.
4.2. Bases neurofisiológicas del trastorno obsesivo-compulsivo.
Juan Carlos Gomez Estaban, Mar Carmona
La fisiopatología del trastorno obsesivo-compulsivo (TOC) es compleja y no bien conocida, aunque se han descrito diversos factores implicados, como factores bioquímicos, genéticos, sociales y conductuales. Las hipótesis más aceptadas postulan una interacción entre ellos como base del cuadro21.
4.2.1 Factores bioquímicos
Los factores bioquímicos que se relacionan con la fisiopatología del TOC son fundamentalmente alteraciones en los neurotransmisores y entre ellos el sistema serotoninérgico, aunque también se sugiere la participación de otros como el sistema dopaminérgico y el glutamatérgico 22.
Aunque no está claro que la serotonina actúe como factor causal, la respuesta a fármacos serotoninérgicos, entre ellos los inhibidores selectivos de la recaptación de serotonina (ISRS) y no selectivos, como la Clomipramina, ha llevado a pensar que existe una disregulación de la serotonina que se asocia a la aparición de obsesiones y compulsiones. La respuesta terapéutica a estos fármacos es mayor que la observada en pacientes con TOC tratados con fármacos noradrenérgicos, por lo que la atención se ha centrado en la serotonina y sus metabolitos. De la misma manera, la respuesta a los fármacos bloqueantes de la dopamina en pacientes con TOC y tics, apoya la hipótesis de la implicación del sistema dopaminérgico.
4.2.2 Factores genéticos
En cuanto a la genética, estudios familiares demuestran mayor prevalencia de TOC en familiares de primer grado frente a controles, llegando a un 12-17 % de familiares de pacientes con TOC. Los estudios en gemelos demuestran mayor concordancia en gemelos monocigotos (65%) que en dicigotos (45%), llegando a presentar una herencia entre parientes de hasta el 80 %, tanto mayor cuanto mayor es el grado de parentesco21.
Se cree que la herencia podría ser poligénica y que los genes implicados son los relacionados con los sistemas serotoninérgico23, dopaminérgico y glutamatérgico24. No obstante, la expresión de estos genes estaría muy influenciada por factores sociales, y el inicio del cuadro con desencadenantes como el trauma psicológico.
4.2.3. Estudios funcionales
La monitorización mediante registro EEG simultáneo con RM cerebral, monitorización intracerebral, magnetoencefalografía y RM funcional ha permitido caracterizar la actividad cerebral de pacientes con TOC. El estudio de la actividad cerebral utilizando estas técnicas ayuda a conocer las características del procesamiento del pensamiento en estos pacientes y así entender la fisiopatología.
Los trabajos se centran fundamentalmente en el procesamiento de errores y la monitorización de la realización de acciones, que parecen estar alterados en estos pacientes, en los que se ha comprobado cómo sus acciones y pensamientos son procesados de manera excesivamente cuidadosa para evitar perder el control o cometer errores.
El procesamiento de los errores implica tanto su reconocimiento como la modulación de respuestas futuras. La presencia de déficits en cualquiera de estas habilidades conlleva la aparición de comportamientos repetitivos, así como rigidez mental. El procesamiento de los errores se asocia a la actividad en la corteza frontal medial anterior/posterior, la ínsula/opérculo anterior, la corteza prefrontal ventrolateral y prefrontal dorsolateral (dlPFC) y la parietal anterior25. Además, el cortex cingulado medial se encarga del control cognitivo para prevenir nuevos errores. Lo que parece ocurrir en estos pacientes es una alteración en el balance entre el auto-control (déficit inhibitorio) y las funciones ejecutivas26. Este desequilibrio se desencadena por una respuesta excitatoria de los ganglios basales (asociada a tareas cognitivas o bien acciones motoras sin control volicional) y a una actividad inhibitoria del córtex orbitofrontal, así como un exceso de control de la corteza cingulada anterior (CCA) para bloquear impulsos inhibitorios. La disfunción ejecutiva se produce por la reducción en la activación de la red neuronal de la corteza parietal-dorsolateral prefrontal. La amplificación en las respuestas de error observadas en pacientes con TOC estaría reflejando una hiperactividad del circuito córtico-estriatal durante la monitorización de una acción 25.
Otras áreas que parecen estar implicadas en la monitorización de la realización de acciones y por tanto en la fisiología del TOC, son la ínsula anterior, regiones del cortex cingulado medial posterior o el área motora suplementaria, así como regiones de la CCA sub-genual, que se han encontrado hiperactivadas en estos pacientes27.
Esto explicaría que los pacientes con TOC tiendan a evaluar los errores de una manera marcadamente desproporcionada. La presencia de señales de error inapropiadas y significativamente exageradas lleva a un sentimiento de inseguridad, con dudas de uno mismo y sentirse incompleto constantemente, lo que desencadena la realización de compulsiones y comportamientos repetitivos. Se postula también que no se trata solo de una alteración en el reconocimiento del error si no que también estaría modulada la respuesta por el significado afectivo de ese error. La asociación de un determinado error con un castigo o consecuencia negativa llevaría a una negatividad relacionada con la respuesta aún mayor, potenciándola y haciendo que esta negatividad dure más. La base neurofisiológica de la compulsión se centra en la fisiología del circuito córtico-estriatal. Aunque la realización de un comportamiento repetitivo se relaciona directamente con la compulsión, es indudable que la ansiedad y el estrés forman parte del TOC, y están relacionados con la afectividad. Es esta afectividad negativa en la que estaría implicado el circuito límbico, estando hiperactivado en estos casos. De entre las estructuras que forman parte de este circuito, sin duda la amígdala es la más relevante, por su implicación en la ansiedad y su interacción con el circuito córtico-estriatal 28.
4.2.3.1 Actividad electrofisiológica
Los estudios de actividad intracortical mediante EEG en pacientes con TOC muestran una hiperactivación frontal medial29. Además, estos pacientes presentan un ritmo alpha frontal asimétrico, con actividad alpha lenta en región frontal (8-10 Hz), de predominio en hemisferio izquierdo. De manera consistente, los pacientes con TOC presentan importantes problemas de sueño. En los estudios de sueño se observan alteraciones significativas, siendo muchas de ellas las que se encuentran en los pacientes con depresión.
El circuito implicado en la fisiopatoloigía del TOC es el córtico-estriato-tálamo-cortical, en el cual el núcleo subtalámico juega un papel fundamental. A través de sus áreas emocionales y sensitivo-motoras se coordinan acciones como la toma de decisiones o la selección de una acción. Además, la estimulación cerebral profunda del NST se ha postulado como diana para el tratamiento del TOC. La realización de registros electrofisiológicos permite el estudio de su actividad en este trastorno. Con la provocación de síntomas obsesivo-compulsivos, se registra un decremento en la actividad theta del NST, mientras que, en las regiones más dorsales del núcleo, se registra una actividad beta similar a la que se encuentra en pacientes con enfermedad de Parkinson30. En esta línea se sitúan los estudios de eficacia de estimulación cerebral profunda (ECP) de otras dianas, como el núcleo accumbens o el pedúnculo talámico inferior, como tratamiento del TOC. La modulación de estructuras que forman parte del circuito hace que existan diversas posibles dianas quirúrgicas para el tratamiento del TOC.
4.2.3.2 Estudios de neuroimagen
Los estudios de neuroimagen funcional demuestran que existe una hiperactivación de la zona dorsal de la corteza cingular anterior (dCCA) en situación de reposo en pacientes con TOC comparados con controles31. Además, existen estudios basados en tareas que utilizan en su mayoría el análisis de inhibición de la respuesta, provocación de síntomas, cambio de paradigma o resolución de conflictos en los que se ha observado una hiperactivación de la dCCA durante tareas conflictivas, así como en inhibición de la respuesta 32.
Por otro lado, la mayoría de los estudios de RM estructural han demostrado una reducción en el grosor cortical y en el volumen de sustancia gris en la CCA, así como reducción de volumen de sustancia blanca en la circunvolución del cíngulo 33.
La disfunción de la CCA tiene como consecuencia la aparición de una señal de control cognitivo aberrante que llevaría a comportamientos y pensamientos patológicos. Así, la identificación errónea de una determinada situación conduce a la realización repetitiva de un comportamiento que no concuerda con el objetivo de esa tarea a largo plazo. La realización de ese comportamiento produce una respuesta negativa, incluyendo el retraso en la consecución del objetivo, falta de refuerzo y aprobación, incomodidad, dolor, errores y otros sentimientos negativos. En un sujeto sano, este resultado subóptimo haría que la CCA ajustara la señal de control para así poner en marcha un comportamiento adecuado al contexto, mientras que en los pacientes con TOC no se anula la respuesta previa no permitiendo generar un cambio adaptativo en la estrategia de respuesta al estímulo. Dicho de otra manera, los pacientes con TOC tienen una gran dificultad en reorientar una respuesta, indicando la imposibilidad para cambiar de comportamiento ante una acción mal hecha. Esta falta de flexibilidad mental es coherente con la activación alterada de la dCCA en estudios de RM funcional y explicará la imposibilidad para dejar de realizar una compulsión una vez que se ha producido la respuesta maladaptativa.
El error en la conceptualización de una respuesta otorga excesiva relevancia a un determinado estímulo, generando comportamientos para abordar la amenaza percibida, la repulsión o conflicto representado por el estímulo. Mientras que en un sujeto sano se producirá un procesamiento correcto de la señal de control para frenar ese comportamiento/compulsión, en el sujeto con TOC, las acciones para afrontar el estímulo ofensivo no dejan reducir la intensidad de la señal de control. Así, persiste ansiedad y un comportamiento que se convierte en fútil, innecesario e inapropiado. Se trataría de una sobreestimación de la amenaza, como consecuencia de una señal de control de la CCA exacerbada. La sensación constante de amenaza produce ansiedad persistente ante estímulos inofensivos y la realización de acciones repetitivas que son ineficaces, pero el paciente no es capaz de cambiar de estrategia a pesar de que siente que su comportamiento es inadecuado para resolver la situación.
En un ejemplo práctico, la sobreestimación de la amenaza que suponen los gérmenes y la exageración en la importancia de la acción de lavarse lleva a la obsesión de contaminación y la compulsión del lavado. Al no poder apagar el sentimiento de amenaza del contaminante, el individuo continúa realizando los rituales de limpieza constantemente. La señal de tarea inacabada persiste, indicando que la tarea no ha sido finalizada, produciendo mayor incapacidad aún para cambiar de estrategia.
No es solo la disfunción de la CCA, sino el resultado de la alteración de la red neuronal de la que la CCA forma parte. Se trata de una red cognitivo/afectiva en la que están también implicadas la corteza orbitofrontal, la corteza prefrontal ventromedial (vmPFC), dlPFC y estructuras límbicas y subcorticales.
Se ha demostrado que en los pacientes con TOC existe una activación funcional alterada durante la realización de test cognitivos que evalúan dominios dependientes de la integridad del circuito fronto-estriatal.
La capacidad de respuesta inhibitoria se puede medir mediante tareas de “hacer-no hacer” así como mediante el paradigma de la señal de parar (test de “stop signal reaction time” SSRT). Ambas pruebas requieren que el sujeto realice una tarea motora como respuesta en algunas situaciones y detener esa respuesta motora en otras situaciones. Déficits en la inhibición de la respuesta se han postulado como posibles marcadores del TOC. Además, la presencia de respuestas de inhibición alteradas, se asocia a una reducción en la sustancia gris de la corteza orbitofrontal y en regiones frontales inferiores derechas junto con un aumento en la corteza cingular y parietal y en circuito fronto-estriatal 34. Además, la dificultad en la inhibición se asocia con una hiperactivación de la corteza motora suplementaria en dichas tareas de “tiempo de reacción”.
Lo que clínicamente se observa en este grupo de pacientes es la realización de actos compulsivos repetitivos que se asocian con la incapacidad para la flexibilidad mental, es decir, la incapacidad para adaptar la conducta y pensamiento a una determinada situación nueva o inesperada o bien ante un cambio. Existe una alteración en la habilidad para cambiar el foco de atención hacia un nuevo foco.
La habilidad para ajustar de manera flexible una respuesta comportamental frente a las respuestas que resultan negativas está facilitado por la activación de la corteza orbitofrontal.
4.3. Manejo terapéutico del TOC en pacientes con síndrome de Tourette
Mónica Kurtis, Diego Santos.
El tratamiento del TOC en los pacientes con ST se basa en la terapia cognitivo-conductual (TCC), el tratamiento farmacológico y la cirugía mediante estimulación cerebral profunda (ECP). Una de las limitaciones para emitir conclusiones es que la evidencia sobre TOC en ST es escasa, ya que la mayoría de los ensayos clínicos randomizados (ECR) son en poblaciones en edad pediátrica o adulta con TOC, sin estratificar por etiología. De hecho, en muchos estudios se excluyen pacientes con ST, tics u otros trastornos (depresión, trastorno bipolar, autismo, psicosis, etc.). El pronóstico del TOC es peor en pacientes con tics o ST 35 por lo que se recomiendan ensayos en estas poblaciones 36.
En general, si el TOC no es grave se recomienda iniciar TCC y si no hay mejoría o la sintomatología es significativa desde el inicio, se puede combinar dicha terapia con fármacos37, quedando la cirugía como terapia más invasiva para casos refractarios. Diferentes sociedades científicas han publicado guías sobre el manejo del TOC 38–40. En el manejo terapéutico, se deben valorar otros síntomas dentro del espectro del ST y su gravedad como tics, depresión, ansiedad, trastornos del sueño e inatención, así como el contexto familiar.
4.3.1.Terapia cognitiva conductual
El modelo cognitivo conductual del TOC propone que ideas o imágenes intrusivas (habituales en la población general) se convierten en obsesiones angustiosas que interfieren con la vida cuando la persona que las tiene las considera amenazantes y se siente responsable de ellas. De esta forma, un estímulo neutro se convierte en amenazante (por ej., el picaporte de una puerta se asocia a la preocupación de contaminación por virus). Las compulsiones y comportamientos relacionados son esfuerzos maladpatativos que buscan eliminar las intrusiones y reducir las consecuencias temidas y que a base de repetición se mantienen en el tiempo por refuerzo negativo 41.
A nivel psicológico se puede intervenir en este “circulo vicioso” mediante la TCC. Existen múltiples manuales de TCC 42que se basan en las siguientes pautas:
1) Educación y terapia cognitiva para corregir las creencias equivocadas del paciente presentando información que las desmiente.
2) “Mapeo” del TOC mediante la enumeración y priorización de ideas e impulsos obsesivos, estímulos que los catalizan y rituales o conductas evitativas.
3) Exposición gradual a situaciones que producen obsesiones (ej. a puertas con picaportes) y prevención de la respuesta disfuncional (lavarse repetidas veces las manos) ayudado por el terapeuta. Esta es la base del tratamiento
4) Prevención de recaídas.
La evidencia actual avala que la TCC se debe considerar como primera línea de tratamiento en todos los grados de severidad de TOC y en todas las edades 43. Una revisión sistemática de 13 ensayos clínicos randomizados (ECR) demostró la eficacia de la TCC frente a placebo en la población pediátrica con un beneficio mantenido en el tiempo de hasta 4 meses 44. En pacientes que no mejoran inicialmente se puede plantear el refuerzo del tratamiento de TCC como sugiere un ECR reciente con 56 pacientes entre 7-17 años. En este estudio, el beneficio de añadir 16 semanas de TCC o añadir sertralina fue equivalente en cuanto a mejoría del TOC 44.
También en la población adulta la TCC ha demostrado beneficio frente a placebo o a la no intervención como demuestra un meta análisis de 37 ECR 45. Estudios con años de seguimiento (29 meses de media) sugieren que en más del 75% de los pacientes, la mejoría de los síntomas se mantiene en el tiempo 46.
El éxito de la TCC depende en gran medida de la adherencia del paciente y de su apoyo familiar. Se postula que los resultados pueden ser menos positivos si existen alteraciones cognitivas, falta de “insight” 47, alteraciones del ánimo severas o abuso de sustancias 48. En nuestro país, el acceso a terapeutas con experiencia en este tipo de terapia es limitado por lo que la posibilidad de TCC grupal podría ser atractiva. Un meta análisis reciente que incluye resultados de 6 ECR comparando TCC grupal con TCC individual encuentra que no hay diferencias de eficacia en cuanto a síntomas de TOC, depresión, ansiedad ni cambios significativos en los abandonos del tratamiento 49.
4.3.2.Tratamiento farmacológico
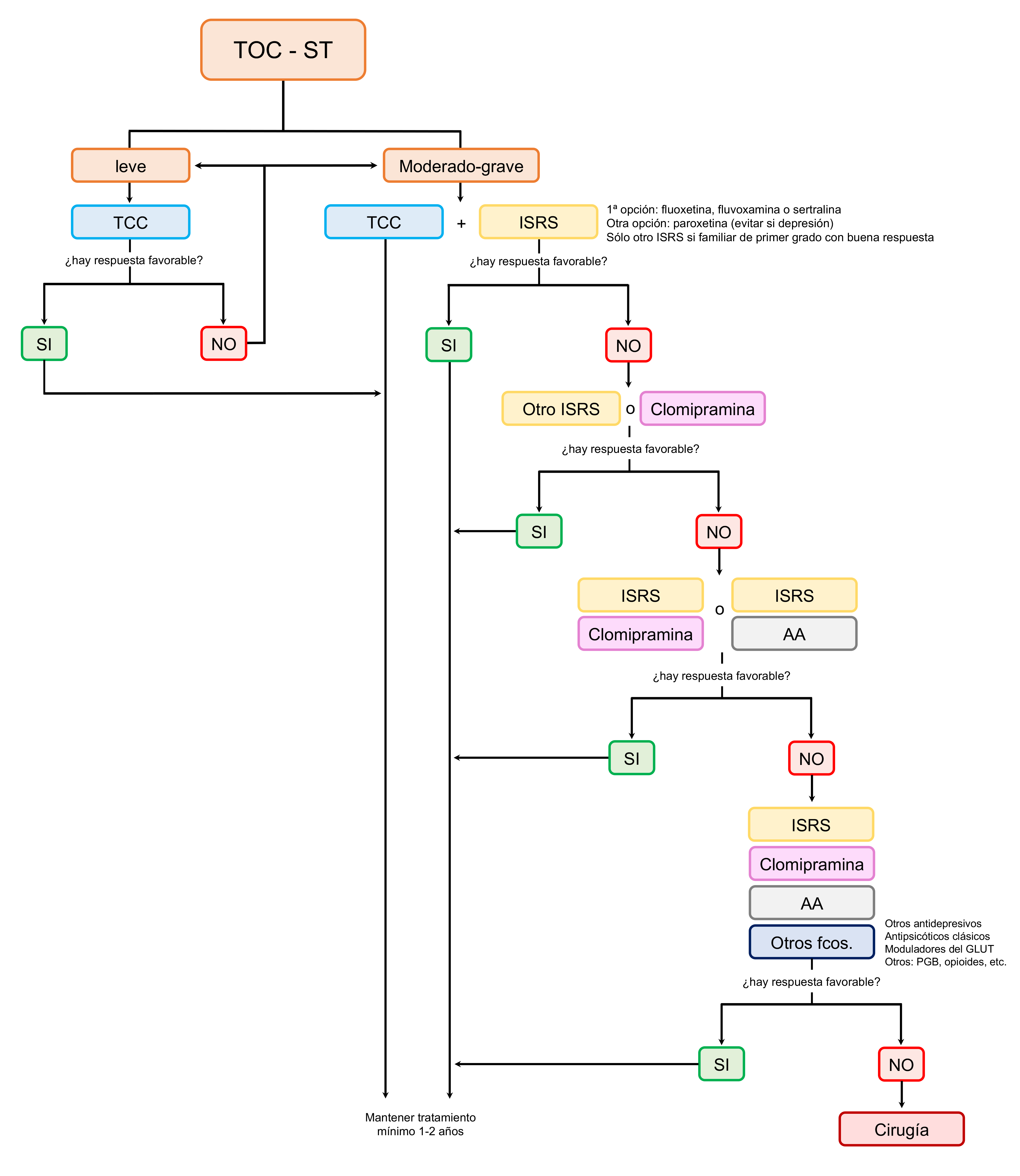
El tratamiento farmacológico incluye los siguientes grupos: 1) ISRS (inhibidores selectivos de la recaptación de serotonina); 2) clomipramina; 3) otros antidepresivos; 4) antipsicóticos; 5) fármacos glutamatérgicos; 6) otros tratamientos. Las recomendaciones son iniciar el tratamiento farmacológico combinado si es posible con TCC y con un sólo fármaco (monoterapia), siendo un ISRS la primera opción debido al perfil de eficacia / seguridad. Si no hay respuesta, puede cambiarse por otro ISRS, asociarse al ISRS otro fármaco o bien cambiar a clomipramina (figura 1). A continuación se muestran los diferentes fármacos que pueden ser utilizados:
4.3.2.1 ISRS (inhibidores selectivos de la recaptación de serotonina)
Se consideran la primera opción teniendo en cuenta el balance eficacia-efectividad / efectos secundarios. Fluoxetina 50 51, fluvoxamina 52 y sertralina 53 54 son los tres ISRS recomendados en población pediátrica. Paroxetina demostró también ser eficaz en un ensayo clínico pero no en pacientes jóvenes con depresión 55, síntoma frecuente asociado al TOC. Un meta-análisis del 2003 que incluye 12 ensayos clínicos (7 ISRS- 3 fluoxetina, 1 fluvoxamina, 1 sertralina, 2 paroxetina-; 5 clomipramina) y un total de 1044 niños y adolescentes con TOC mostró un beneficio de los ISRS frente a placebo con una mejoría de 4 puntos en la escala Children’s Yale-Brown Obsessive Compulsive Scale (YBOCS) 36. En adultos, un meta-análisis con 17 estudios y 3097 participantes demostró que los ISRS mejoran también el TOC frente a placebo 56. Otro meta-análisis más reciente 57 mostró que el efecto del ISRS se observa a partir de la 2º semana, y que es similar la respuesta en población pediátrica que en adultos, y a diferencia de otros previos 58, no encuentra relación entre una mayor dosis y una mayor respuesta. Fluoxetina, fluvoxamina y sertralina además han demostrado mejorar la ansiedad y en menor medida la depresión en población pediátrica 56.
Se recomienda iniciar con dosis bajas e ir subiendo progresivamente según la respuesta. El mantenimiento del fármaco debe extenderse al menos entre 1 y 2 años según la respuesta 59. En la fase de extensión de un estudio con sertralina observaron remisión completa y parcial en el 55% y 31% después de 1 año, respectivamente 60. Otros ISRS como citalopram o escitalopram podrían utilizarse como alternativa pero su eficacia no ha sido estudiada, por lo que en general sólo se plantearía el uso de un ISRS distinto de los 4 recomendados cuando hay experiencia previa de respuesta favorable en un familiar de primer grado.
Los ISRS son fármacos bien tolerados y los efectos secundarios suelen ser típicamente dosis-dependiente y frecuentemente desaparecen con el tiempo. Aunque es un tema controvertido, no hay evidencia suficiente para pensar en un incremento del riesgo de suicidio en población pediátrica relacionada con ningún ISRS pero es necesario vigilar el riesgo de desarrollo de manía en niños y jóvenes.
4.3.2.2 Clomipramina
Es el único antidepresivo tricíclico que ha demostrado ser eficaz en el tratamiento del TOC 36. Su mecanismo de acción incluye también la inhibición de la recaptación de serotonina y noradrenalina. Hasta el 40% pueden mejorar síntomas del TOC después de 8 semanas de tratamiento y mantenerse después de 1 año, si bien entre el 30 y 60% pueden desarrollar efectos secundarios como boca seca, mareos, fatiga o somnolencia. Como otros tricíclicos puede provocar enlentecimiento de la conducción cardiaca y raramente muerte súbita en jóvenes, por lo que es necesaria una evaluación cardiológica basal y monitorización con ECG en el seguimiento. En caso de sospecha de toxicidad pueden solicitarse niveles en sangre (debe evitarse consumir pomelo dado que eleva los niveles de clomipramina en sangre). Diferentes estudios comparativos entre clomipramina y un ISRS (fluoxetina, fluvoxamina, sertralina o paroxetina) no demostraron diferencias en cuanto a eficacia 61 62 63 64.
4.3.2.3 Otros antidepresivos
El uso de otros antidepresivos en TOC diferentes de los ISRS y clomipramina esta sujeto a la falta de evidencia.
La mayor evidencia es para venlafaxina. En algunos estudios comparativos, antidepresivos duales (acción serotonérgica y noradrenérgica) como la venlafaxina tuvieron un efecto similar a un ISRS y podrían ser utilizados en pacientes con determinadas comorbilidades. La hipótesis del posible beneficio del incremento de noradrenalina se sustenta en la mejoría que produce la clomipramina. Un estudio abierto con venlafaxina encontró una tasa de respuesta del 76% de pacientes con TOC refractario a ISRS 59 65. Sin embargo, la tasa de respuesta frente a paroxetina fue menor, del 19% frente al 56%, en un estudio doble ciego cruzado 66. No hay ensayos clínicos randomnizados doble ciego con desvenlafaxina, duloxetina, mirtazapina, agomelatina, vortioxetina y vilazodona.
Por tanto, no hay evidencia para recomendar un antidepresivo dual u otro antidepresivo diferente de un ISRS o clomipramina en monoterapia para tratar el TOC, salvo en segunda línea.
4.3.2.4 Antipsicóticos
No se utilizan en monoterapia sino asociados a un antidepresivo ya que pueden potencian el beneficio sobre los síntomas del TOC; lo que se denomina “augmentation”. En adultos, haloperidol, risperidona, quetiapina, olanzapina y aripiprazol han demostrado en ensayos randomizados aumentar la respuesta del ISRS, aunque también ha habido algunos ensayos con resultados negativos 67 68. Un meta-análisis con 14 estudios doble ciego y un total de 491 pacientes sugiere que asociar un antipsicótico puede conseguir mejoría en 1 de cada 3 pacientes siendo risperidona, aripiprazol y haloperidol los más eficaces 68. Los pacientes con mínima respuesta a un ISRS o con múltiples tics son los que más pueden beneficiarse. La evidencia es con dosis bajas (por ejemplo, de 0.5 a 2 mg de risperidona) y puede observarse respuesta a partir del primer mes. En la población pediátrica se prefieren los antipsicóticos de segunda generación como risperidona u olanzapina y debe tenerse en cuenta que los niños, especialmente los preadolescentes, son más sensibles a los efectos secundarios, particularmente la ganancia de peso, diabetes o síndrome metabólico.
4.3.2.5 Fármacos glutamatérgicos
El glutamato ha sido considerado un neurotransmisor implicado en la neurobiología del TOC y algunos fármacos moduladores del glutamato como riluzole, N-acetil-cisteína, memantina, ketamina, sarcosina, D-cicloserina, lamotrigina o topiramato han sido estudiados con resultados diversos en monoterapia o como terapia añadida 69. Sin embargo, la evidencia es insuficiente para recomendar su uso ya que hay pocos ensayos clínicos y los resultados no concluyentes. Así, el resultado de 2 ensayos clínicos; 1 con riluzole 70 y otro con N-acetilcisteína 71 fueron negativos, mientras que un ensayo randomizado con memantina frente a placebo como terapia añadida a la fluvoxamina fue favorable 72.
4.3.2.6 Otros fármacos
En población pediátrica se han realizado ensayos con otras moléculas asociadas a ISRS o clomipramina como litio, buspirona u hormona tiroidea pero los resultados fueron negativos 73. En adultos, diferentes fármacos en terapia añadida como litio, buspirona, clonazepam, pindolol, desipramina, ondansetrón, d-anfetamina, cafeína, celecoxib, pregabalina u opiáceos (morfina o tramadol) han mostrado algún resultado favorable en series de casos o estudios abiertos pero, o74 no hay ensayos realizados, o fueron negativos o positivos con pocos pacientes y/o sin replicar 73. Por tanto, no hay evidencia para recomendar su uso. Sólo se podrían plantear en casos concretos refractarios.
5.3.3 Algoritmo terapéutico del TOC: inicio, mantenimiento y retirada del tratamiento
La figura 1 muestra cómo realizar el manejo terapéutico del TOC en el ST. La TCC es el tratamiento de primera línea. Si no funcionase se puede considerar reforzar el tratamiento con más sesiones o añadir tratamiento farmacológico. El tratamiento farmacológico combinado con terapia cognitivo-conductual es preferible dado el mayor beneficio frente al tratamiento farmacológico solo 54 La recomendación es iniciar un ISRS (fluoxetina, fluvoxamina o sertralina), cambiar a otro ISRS o a clomipramina. Si no hay respuesta, se pueden asociar ambos o asociar un antipsicótico atípico (por ejemplo risperidona) al ISRS 59 81 82 40 73. La introducción será siempre gradual para minimizar efectos secundarios. Debe tenerse en cuenta que el paciente puede estar recibiendo un fármaco antidopaminérgico como tratamiento sintomático de los tics independientemente de que pueda tener síntomas de TOC.
El tiempo mínimo de mantenimiento de la terapia será de 1 ó 2 años y, si hay mejoría, podría plantease la retira de forma progresiva y gradual 59 38 39 40 73. Sin embargo, dada la cronicidad de la sintomatología, muchas veces la terapia deberá ser mantenida en el tiempo con los correspondientes ajustes según los cambios de peso y evolución.
CONCLUSIONES
El TOC es un trastorno neuropsiquiátrico frecuente en el ST que coexiste con los tics característicos de este síndrome siendo difícil de diferenciar de los mismos cuando los tics son complejos y las conductas compulsivas tienen un componente motor repetido. A diferencia de las conductas obsesivo-compulsivas, el TOC se asocia a angustia muy significativa y mala calidad de vida por lo que la identificación del mismo en el ST y la instauración de un tratamiento apropiado es de gran relevancia. La fisiopatología del TOC en el ST es compleja existiendo alteraciones en distintos neurotransmisores entre los que la serotonina es el mas relevante. Además se produce una disfunción en los circuitos cerebrales responsables del control inhibitorio y la función ejecutiva así como en el sistema límbico que conducen en ultimo termino a una incapacidad de inhibir la elaboración de pensamientos obsesivos con gran angustia que se trata de liberar mediante la realización de una compulsión.
La TCC sola o en asociación a fármacos (ISRS, preferiblemente fluoxetina, fluvoxamina o sertralina), según la gravedad del TOC, es el tratamiento de primera línea. Es preferible la combinación de TCC con fármacos que los fármacos solos. En caso de fallo terapéutico de varios ISRS en monoterapia pueden usarse de segunda línea la clomipramina o un antipsicótico atípico en asociación con ISRS o clomipramina. El uso de otros fármacos (glutamatérgicos, opiáceos, otros antidepresivos) puede considerarse si no se ha logrado un adecuado control con los fármacos habituales. En casos graves y refractarios a todas las terapias previas debe considerar la posibilidad de tratamiento quirúrgico con ECP.
Pie de figura 1. Algoritmo sobre el tratamiento del TOC en pacientes con ST. AA, antipsicótico atípico; fcos, fármacos; ISRS, inhibidos selectivo de la recaptación de serotonina; ST, síndrome de Tourette; TCC, terapia cognitivo-conductual; TOC, trastorno obsesivo-compulsivo.
REFERENCIAS
- Hirschtritt ME, Lee PC, Pauls DL, et al. Lifetime prevalence, age of risk, and genetic relationships of comorbid psychiatric disorders in tourette syndrome. JAMA Psychiatry. 2015;72:325–333.
- Robertson MM. A personal 35 year perspective on Gilles de la Tourette syndrome: prevalence, phenomenology, comorbidities, and coexistent psychopathologies. The Lancet Psychiatry. 2015;2:68–87.
- Jankovic J. Tourette’s Syndrome. N Engl J Med. 2001;345:1184–1192.
- Kurlan RM. Tourette’s Syndrome. N Engl J Med. 2011;363:2332–2338.
- Freeman RD, Fast DK, Burd L, Kerbeshian J, Robertson MM, Sandor P. An international perspective on Tourette syndrome: Selected findings from 3500 individuals in 22 countries. Dev Med Child Neurol. 2000;42:436–447.
- Burd L, Li Q, Kerbeshian J, Klug MG, Freeman RD. Tourette Syndrome and Comorbid Pervasive Developmental Disorders. J Child Neurol. 2009;24:170–175.
- Mercado G, Castillo V, Soto P, et al. Targeting PERK signaling with the small molecule GSK2606414 prevents neurodegeneration in a model of Parkinson’s disease. Neurobiol Dis. 2018;112:136–148.
- Mol Debes NMM, Hjalgrim H, Skov L. Validation of the presence of comorbidities in a Danish clinical cohort of children with Tourette syndrome. J Child Neurol. 2008;23:1017–1027.
- Worbe Y, Mallet L, Golmard J-L, et al. Repetitive Behaviours in Patients with Gilles de la Tourette Syndrome: Tics, Compulsions, or Both? Sirigu A, editor. PLoS One. 2010;5:e12959.
- Hartmann A, Worbe Y. Tourette syndrome. Curr Opin Neurol. 2018;31:1.
- Hartmann A, Millet B. Repetitive movements and behaviors in neurological and psychiatric practice: Distinctions and similarities between Tourette disorder and obsessive–compulsive disorder. Rev Neurol (Paris). 2018;174:199–202.
- APA. Diagnostic and Statistical Manual of Mental Disorders (DSM-5). American Psychiatric Association, editor. Washington: American Psychiatric Association; 2013.
- Miguel EC, Coffey BJ, Baer L, Savage CR, Rauch SL, Jenike MA. Phenomenology of intentional repetitive behaviors in obsessive-compulsive disorder and Tourette’s disorder. J Clin Psychiatry. 1995;56:246–255.
- Lombroso PJ, Scahill L. Tourette syndrome and obsessive–compulsive disorder. Brain Dev. 2008;30:231–237.
- Leckman JF, Walker DE, Goodman WK, Pauls DL, Cohen DJ. “Just right” perceptions associated with compulsive behaviour in Tourette’s syndrome. Am J Psychiatry. 1994;151:675–680.
- Eapen V, Robertson MM, Alsobrook JP, Pauls DL. Obsessive compulsive symptoms in Gilles de la Tourette syndrome and obsessive compulsive disorder: differences by diagnosis and family history. Am J Med Genet. 1997;74:432–438.
- Frankel M, Cummings JL, Robertson MM, Trimble MR, Hill MA, Benson DF. Obsessions and compulsions in Gilles de la Tourette’s syndrome. Neurology. 1986;36:378–382.
- George MS, Trimble MR, Ring HA, Sallee FR, Robertson MM. Obsessions in obsessive-compulsive disorder with and without Gilles de la Tourette’s syndrome. Am J Psychiatry. 1993;150:93–97.
- Robertson MM, Channon S, Baker J, Flynn D. The psychopathology of Gilles de la Tourette’s syndrome. A controlled study. Br J Psychiatry. 1993;162:114–117.
- Mula M, Cavanna AE, Critchley H, Robertson MM, Monaco F. Phenomenology of Obsessive Compulsive Disorder in Patients with Temporal Lobe Epilepsy or Tourette Syndrome. J Neuropsychiatry Clin Neurosci. 2008;20:223–226.
- Mataix-Cols D, Boman M, Monzani B, et al. Population-based, multi-generational family clustering study of social anxiety disorder and avoidant personality disorder. Psychol Med. 2015;45:1581–1589.
- Goodman WK, Grice DE, Lapidus KAB, Coffey BJ. Obsessive-compulsive disorder [online]. Psychiatr. Clin. North Am. Elsevier; 2014. p. 257–267. Accessed at: https://www.sciencedirect.com/science/article/pii/S0193953X14000586?via%3Dihub.
- Sinopoli VM, Burton CL, Kronenberg S, Arnold PD. A review of the role of serotonin system genes in obsessive-compulsive disorder [online]. Neurosci. Biobehav. Rev. 2017. p. 372–381. Accessed at: file:///Users/marcarmonaabellan/Library/Application Support/Mendeley Desktop/Downloaded/Sinopoli, Burton, Arnold - 2017 - A review of the role of serotonin system genes in obsessive-compulsive disorder.pdf.
- Pauls DL, Abramovitch A, Rauch SL, Geller DA. Obsessive-compulsive disorder: An integrative genetic and neurobiological perspective. Nat Rev Neurosci. 2014;15:410–424.
- Grützmann R, Endrass T, Kaufmann C, Allen E, Eichele T, Kathmann N. Presupplementary Motor Area Contributes to Altered Error Monitoring in Obsessive-Compulsive Disorder. Biol Psychiatry [online serial]. Elsevier; 2016;80:562–571. Accessed at: http://dx.doi.org/10.1016/j.biopsych.2014.12.010.
- Melloni M, Urbistondo C, Sedeño L, Gelormini C, Kichic R, Ibanez A. The extended fronto-striatal model of obsessive compulsive disorder: convergence from event-related potentials, neuropsychology and neuroimaging. Front Hum Neurosci [online serial]. 2012;6:1–24. Accessed at: http://journal.frontiersin.org/article/10.3389/fnhum.2012.00259/abstract.
- Agam Y, Greenberg JL, Isom M, et al. Aberrant error processing in relation to symptom severity in obsessive-compulsive disorder: A multimodal neuroimaging study. NeuroImage Clin. 2014;5:141–151.
- van den Heuvel OA, van Wingen G, Soriano-Mas C, et al. Brain circuitry of compulsivity. Eur Neuropsychopharmacol [online serial]. Elsevier; 2016;26:810–827. Accessed at: http://dx.doi.org/10.1016/j.euroneuro.2015.12.005.
- Koprivova J, Congedo M, Horacek J, et al. EEG source analysis in obsessive-compulsive disorder. Clin Neurophysiol [online serial]. 2011;122:1735–1743. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/21354363%5Cnpapers2://publication/doi/10.1016/j.clinph.2011.01.051.
- Rappel P, Marmor O, Bick AS, et al. Subthalamic theta activity: a novel human subcortical biomarker for obsessive compulsive disorder. Transl Psychiatry [online serial]. Springer US; 2018;8:118. Accessed at: http://www.nature.com/articles/s41398-018-0165-z.
- Anticevic A, Hu S, Zhang S, et al. Global resting-state functional magnetic resonance imaging analysis identifies frontal cortex, striatal, and cerebellar dysconnectivity in obsessive-compulsive disorder. Biol Psychiatry. 2014;75:595–605.
- McGovern RA, Sheth SA. Role of the dorsal anterior cingulate cortex in obsessive-compulsive disorder: converging evidence from cognitive neuroscience and psychiatric neurosurgery. J Neurosurg [online serial]. 2017;126:132–147. Accessed at: http://thejns.org/doi/10.3171/2016.1.JNS15601.
- Hoexter MQ, de Souza Duran FL, D’Alcante CC, et al. Gray Matter Volumes in Obsessive-Compulsive Disorder Before and After Fluoxetine or Cognitive-Behavior Therapy: A Randomized Clinical Trial. NEUROPSYCHOPHARMACOLOGY. 2012;37:734–745.
- Menzies L, Chamberlain SR, Laird AR, Thelen SM, Sahakian BJ, Bullmore ET. Integrating evidence from neuroimaging and neuropsychological studies of obsessive-compulsive disorder: The orbitofronto-striatal model revisited. Neurosci. Biobehav. Rev. 2008. p. 525–549.
- Peterson BS, Pine DS, Cohen P, Brook JS. Prospective, longitudinal study of tic, obsessive-compulsive, and attention-deficit/hyperactivity disorders in an epidemiological sample. J Am Acad Child Adolesc Psychiatry [online serial]. 2001;40:685–695. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/11392347. Accessed April 26, 2019.
- Geller DA, Biederman J, Stewart SE, et al. Impact of comorbidity on treatment response to paroxetine in pediatric obsessive-compulsive disorder: is the use of exclusion criteria empirically supported in randomized clinical trials? J Child Adolesc Psychopharmacol [online serial]. 2003;13 Suppl 1:S19-29. Accessed at: http://www.liebertpub.com/doi/10.1089/104454603322126313. Accessed April 26, 2019.
- Wheaton MG, DeSantis SM, Simpson HB. Network meta-analyses and treatment recommendations for obsessive-compulsive disorder. The lancet Psychiatry [online serial]. 2016;3:920. Accessed at: https://linkinghub.elsevier.com/retrieve/pii/S2215036616302802. Accessed April 26, 2019.
- Bandelow B, Sher L, Bunevicius R, et al. Guidelines for the pharmacological treatment of anxiety disorders, obsessive-compulsive disorder and posttraumatic stress disorder in primary care. Int J Psychiatry Clin Pract [online serial]. 2012;16:77–84. Accessed at: http://www.tandfonline.com/doi/full/10.3109/13651501.2012.667114. Accessed April 26, 2019.
- Katzman MA, Bleau P, Blier P, et al. Canadian clinical practice guidelines for the management of anxiety, posttraumatic stress and obsessive-compulsive disorders. BMC Psychiatry [online serial]. 2014;14 Suppl 1:S1. Accessed at: http://bmcpsychiatry.biomedcentral.com/articles/10.1186/1471-244X-14-S1-S1. Accessed April 26, 2019.
- Baldwin DS, Anderson IM, Nutt DJ, et al. Evidence-based pharmacological treatment of anxiety disorders, post-traumatic stress disorder and obsessive-compulsive disorder: a revision of the 2005 guidelines from the British Association for Psychopharmacology. J Psychopharmacol [online serial]. 2014;28:403–439. Accessed at: http://journals.sagepub.com/doi/10.1177/0269881114525674. Accessed April 26, 2019.
- Fineberg NA, Reghunandanan S, Simpson HB, et al. Obsessive-compulsive disorder (OCD): Practical strategies for pharmacological and somatic treatment in adults. Psychiatry Res [online serial]. 2015;227:114–125. Accessed at: https://linkinghub.elsevier.com/retrieve/pii/S016517811400986X. Accessed April 26, 2019.
- Lewin AB, Wu MS, McGuire JF, Storch EA. Cognitive Behavior Therapy for Obsessive-Compulsive and Related Disorders. Psychiatr Clin North Am [online serial]. 2014;37:415–445. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/25150570. Accessed April 26, 2019.
- Lewin AB, Wu MS. Cognitive Behavior T h e r a p y fo r O b s e s s i v e - C o m p u l s i v e a n d R e l a t e d D i s o rd e r s. Psychiatr Clin N. 2014;37:415–445.
- Skarphedinsson G, Hanssen-Bauer K, Kornør H, et al. Standard individual cognitive behaviour therapy for paediatric obsessive-compulsive disorder: a systematic review of effect estimates across comparisons. Nord J Psychiatry [online serial]. 2015;69:81–92. Accessed at: http://www.tandfonline.com/doi/full/10.3109/08039488.2014.941395. Accessed April 26, 2019.
- Öst L-G, Havnen A, Hansen B, Kvale G. Cognitive behavioral treatments of obsessive-compulsive disorder. A systematic review and meta-analysis of studies published 1993-2014. Clin Psychol Rev [online serial]. 2015;40:156–169. Accessed at: https://linkinghub.elsevier.com/retrieve/pii/S0272735815000938. Accessed April 26, 2019.
- Foa EB, Kozak MJ. Psychological treatment for obsessive-compulsive disorder. Long-term Treat anxiety Disord. Arlington, VA, US: American Psychiatric Association; 1996. p. 285–309.
- Foa EB. Feared Consequences , Fixity of Belief , and Treatment Outcome in Patients With Obsessive-Compulsive Disorder. Epub 1999.:717–724.
- Street GP. Effects of Comorbid Depression on Response to Treatment for Obsessive-Compulsive Disorder. Epub 2000.:517–528.
- Pozza A, Dèttore D. Drop-out and efficacy of group versus individual cognitive behavioural therapy: What works best for Obsessive-Compulsive Disorder? A systematic review and meta-analysis of direct comparisons. Psychiatry Res [online serial]. 2017;258:24–36. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/28982038.
- Geller DA, Hoog SL, Heiligenstein JH, et al. Fluoxetine treatment for obsessive-compulsive disorder in children and adolescents: a placebo-controlled clinical trial. J Am Acad Child Adolesc Psychiatry [online serial]. 2001;40:773–779. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/11437015. Accessed April 26, 2019.
- Liebowitz MR, Turner SM, Piacentini J, et al. Fluoxetine in children and adolescents with OCD: a placebo-controlled trial. J Am Acad Child Adolesc Psychiatry [online serial]. 2002;41:1431–1438. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/12447029. Accessed April 26, 2019.
- Riddle MA, Reeve EA, Yaryura-Tobias JA, et al. Fluvoxamine for children and adolescents with obsessive-compulsive disorder: a randomized, controlled, multicenter trial. J Am Acad Child Adolesc Psychiatry [online serial]. 2001;40:222–229. Accessed at: https://linkinghub.elsevier.com/retrieve/pii/S0890856709603725. Accessed April 26, 2019.
- March JS, Biederman J, Wolkow R, et al. Sertraline in children and adolescents with obsessive-compulsive disorder: a multicenter randomized controlled trial. JAMA [online serial]. 1998;280:1752–1756. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/9842950. Accessed April 26, 2019.
- Pediatric OCD Treatment Study (POTS) Team. Cognitive-Behavior Therapy, Sertraline, and Their Combination for Children and Adolescents With Obsessive-Compulsive Disorder. JAMA [online serial]. 2004;292:1969. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/15507582. Accessed April 26, 2019.
- GELLER DA, WAGNER KD, EMSLIE G, et al. Paroxetine Treatment in Children and Adolescents With Obsessive-Compulsive Disorder: A Randomized, Multicenter, Double-Blind, Placebo-Controlled Trial. J Am Acad Child Adolesc Psychiatry [online serial]. 2004;43:1387–1396. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/15502598. Accessed April 26, 2019.
- Soomro GM, Altman DG, Rajagopal S, Oakley Browne M. Selective serotonin re-uptake inhibitors (SSRIs) versus placebo for obsessive compulsive disorder (OCD). Cochrane Database Syst Rev [online serial]. Epub 2008 Jan 23.:CD001765. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/18253995. Accessed April 26, 2019.
- Varigonda AL, Jakubovski E, Bloch MH. Systematic Review and Meta-Analysis: Early Treatment Responses of Selective Serotonin Reuptake Inhibitors and Clomipramine in Pediatric Obsessive-Compulsive Disorder. J Am Acad Child Adolesc Psychiatry [online serial]. 2016;55:851-859.e2. Accessed at: https://linkinghub.elsevier.com/retrieve/pii/S0890856716311601. Accessed April 26, 2019.
- Issari Y, Jakubovski E, Bartley CA, Pittenger C, Bloch MH. Early Onset of Response With Selective Serotonin Reuptake Inhibitors in Obsessive-Compulsive Disorder: A Meta-Analysis. J Clin Psychiatry [online serial]. 2016;77:e605–e611. Accessed at: https://www.psychiatrist.com/jcp/article/Pages/2016/v77n05/v77n0515.aspx. Accessed April 26, 2019.
- Koran LM, Hanna GL, Hollander E, Nestadt G, Simpson HB, American Psychiatric Association. Practice guideline for the treatment of patients with obsessive-compulsive disorder. Am J Psychiatry [online serial]. 2007;164:5–53. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/17849776. Accessed April 26, 2019.
- Wagner KD, Cook EH, Chung H, Messig M. Remission status after long-term sertraline treatment of pediatric obsessive-compulsive disorder. J Child Adolesc Psychopharmacol [online serial]. 2003;13 Suppl 1:S53-60. Accessed at: http://www.liebertpub.com/doi/10.1089/104454603322126340. Accessed April 26, 2019.
- López-Ibor JJ, Saiz J, Cottraux J, et al. Double-blind comparison of fluoxetine versus clomipramine in the treatment of obsessive compulsive disorder. Eur Neuropsychopharmacol [online serial]. 1996;6:111–118. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/8791036. Accessed April 26, 2019.
- Zohar J, Judge R. Paroxetine versus clomipramine in the treatment of obsessive-compulsive disorder. OCD Paroxetine Study Investigators. Br J Psychiatry [online serial]. 1996;169:468–474. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/8894198. Accessed April 26, 2019.
- Bisserbe J, Lane R, Flament M, Franco-Belgian OCD Study Group. A double-blind comparison of sertraline and clomipramine in outpatients with obsessive-compulsive disorder. Eur Psychiatry [online serial]. 1997;12:82–93. Accessed at: https://linkinghub.elsevier.com/retrieve/pii/S0924933897896460. Accessed April 26, 2019.
- Mundo E, Maina G, Uslenghi C. Multicentre, double-blind, comparison of fluvoxamine and clomipramine in the treatment of obsessive-compulsive disorder. Int Clin Psychopharmacol [online serial]. 2000;15:69–76. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/10759337. Accessed April 26, 2019.
- Hollander E, Friedberg J, Wasserman S, Allen A, Birnbaum M, Koran LM. Venlafaxine in treatment-resistant obsessive-compulsive disorder. J Clin Psychiatry [online serial]. 2003;64:546–550. Accessed at: http://psychiatryonline.org/doi/abs/10.1176/appi.neuropsych.13080186. Accessed April 26, 2019.
- Denys D, van Megen HJGM, van der Wee N, Westenberg HGM. A double-blind switch study of paroxetine and venlafaxine in obsessive-compulsive disorder. J Clin Psychiatry [online serial]. 2004;65:37–43. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/14744166. Accessed April 26, 2019.
- Veale D, Miles S, Smallcombe N, Ghezai H, Goldacre B, Hodsoll J. Atypical antipsychotic augmentation in SSRI treatment refractory obsessive-compulsive disorder: a systematic review and meta-analysis. BMC Psychiatry [online serial]. 2014;14:317. Accessed at: http://bmcpsychiatry.biomedcentral.com/articles/10.1186/s12888-014-0317-5. Accessed April 26, 2019.
- Dold M, Aigner M, Lanzenberger R, Kasper S. Antipsychotic Augmentation of Serotonin Reuptake Inhibitors in Treatment-Resistant Obsessive-Compulsive Disorder: An Update Meta-Analysis of Double-Blind, Randomized, Placebo-Controlled Trials. Int J Neuropsychopharmacol [online serial]. 2015;18:pyv047. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/25939614. Accessed April 26, 2019.
- Macmaster FP, Rosenberg DR. Glutamate and the Treatment of Obsessive-Compulsive Disorder. Psychopharm Rev timely reports Psychopharmacol device-based Ther [online serial]. 2010;45:33–40. Accessed at: https://insights.ovid.com/crossref?an=01300408-201005000-00002. Accessed April 26, 2019.
- Grant PJ, Joseph LA, Farmer CA, et al. 12-week, placebo-controlled trial of add-on riluzole in the treatment of childhood-onset obsessive-compulsive disorder. Neuropsychopharmacology [online serial]. 2014;39:1453–1459. Accessed at: http://www.nature.com/articles/npp2013343. Accessed April 26, 2019.
- Sarris J, Oliver G, Camfield DA, et al. N-Acetyl Cysteine (NAC) in the Treatment of Obsessive-Compulsive Disorder: A 16-Week, Double-Blind, Randomised, Placebo-Controlled Study. CNS Drugs [online serial]. 2015;29:801–809. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/26374743. Accessed April 26, 2019.
- Ghaleiha A, Entezari N, Modabbernia A, et al. Memantine add-on in moderate to severe obsessive-compulsive disorder: randomized double-blind placebo-controlled study. J Psychiatr Res [online serial]. 2013;47:175–180. Accessed at: https://linkinghub.elsevier.com/retrieve/pii/S0022395612002956. Accessed April 26, 2019.
- Albert U, Marazziti D, Di Salvo G, Solia F, Rosso G, Maina G. A Systematic Review of Evidence-based Treatment Strategies for Obsessive- compulsive Disorder Resistant to first-line Pharmacotherapy. Curr Med Chem [online serial]. 2018;25:5647–5661. Accessed at: http://www.eurekaselect.com/158569/article. Accessed April 26, 2019.
- Robertson MMMMMM, Cath DC, Hedderly T, et al. Tourette ’ s Syndrome 2 A personal 35 year perspective on Gilles de la Tourette syndrome : assessment , investigations , and management Introduction : assessment of individuals with Tourette syndrome. The Lancet Psychiatry [online serial]. 2015;2:88–104. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/17280810%5Cnhttp://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=3893393&tool=pmcentrez&rendertype=abstract%255Cnhttp://www.ncbi.nlm.nih.gov/pubmed/23731209%255Cnhttp://aut.sagepub.com/cgi/doi/10.1177/13623613135003.
- Denys D. Pharmacotherapy of obsessive-compulsive disorder and obsessive-compulsive spectrum disorders. Psychiatr Clin North Am [online serial]. 2006;29:553–584, xi. Accessed at: https://linkinghub.elsevier.com/retrieve/pii/S0193953X06000268. Accessed April 26, 2019.
- Martinez-Ramirez D, Jimenez-Shahed J, Leckman JF, et al. Efficacy and Safety of Deep Brain Stimulation in Tourette Syndrome: The International Tourette Syndrome Deep Brain Stimulation Public Database and Registry. JAMA Neurol [online serial]. 2018;75:353–359. Accessed at: http://archneur.jamanetwork.com/article.aspx?doi=10.1001/jamaneurol.2017.4317. Accessed April 26, 2019.
- Akbarian-Tefaghi L, Zrinzo L, Foltynie T. The use of deep brain stimulation in tourette syndrome. Brain Sci. 2016;6.
- Porta M, Servello D, Zanaboni C, et al. Deep brain stimulation for treatment of refractory Tourette syndrome: long-term follow-up. Acta Neurochir (Wien) [online serial]. 2012;154:2029–2041. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/22961243. Accessed April 26, 2019.
- Nair G, Evans A, Bear RE, Velakoulis D, Bittar RG. The anteromedial GPi as a new target for deep brain stimulation in obsessive compulsive disorder. J Clin Neurosci [online serial]. 2014;21:815–821. Accessed at: https://linkinghub.elsevier.com/retrieve/pii/S0967586813005432. Accessed April 26, 2019.
- Miguel EC, Lopes AC, McLaughlin NCR, et al. Evolution of gamma knife capsulotomy for intractable obsessive-compulsive disorder. Mol Psychiatry [online serial]. 2019;24:218–240. Accessed at: http://www.ncbi.nlm.nih.gov/pubmed/29743581. Accessed April 26, 2019.
- B. B, L. S, R. B, et al. Guidelines for the pharmacological treatment of anxiety disorders, obsessive-compulsive disorder and posttraumatic stress disorder in primary care. Int J Psychiatry Clin Pract [online serial]. 2012;16:77–84. Accessed at: http://www.embase.com/search/results?subaction=viewrecord&from=export&id=L364792389%0Ahttp://dx.doi.org/10.3109/13651501.2012.667114%0Ahttp://sfx.library.uu.nl/utrecht?sid=EMBASE&issn=13651501&id=doi:10.3109%2F13651501.2012.667114&atitle=Guidelines+for+th.
- M.A. K, P. BB, P. BB, et al. Canadian clinical practice guidelines for the management of anxiety, posttraumatic stress and obsessive-compulsive disorders. BMC Psychiatry [online serial]. 2014;14:no pagination. Accessed at: http://www.biomedcentral.com/1471-244X/14/S1/S1%5Cnhttp://ovidsp.ovid.com/ovidweb.cgi?T=JS&PAGE=reference&D=emed16&NEWS=N&AN=373462224%5Cnhttp://ovidsp.ovid.com/ovidweb.cgi?T=JS&PAGE=reference&D=medl&NEWS=N&AN=25081580.
| Capítulo 3: Trastornos afectivos y cognitivos en el síndrome de Tourette del adulto. | INDICE | Capítulo 5: Otros trastornos de conducta asociados al síndrome de Tourette |